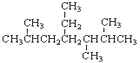
题目内容
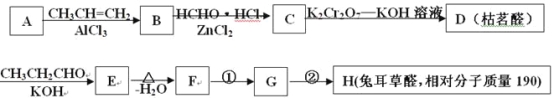
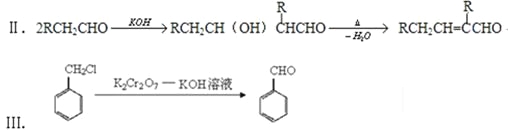
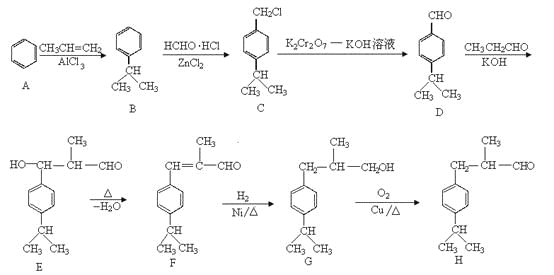
【题目】兔耳草醛H是一种重要的香料,主要用于食品、化妆品等工业中。用有机物A为原料可以合成兔耳草醛H,其合成路线如图所示:
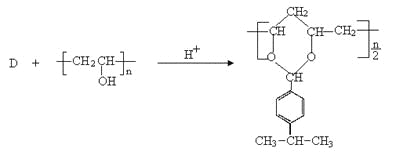
中间产物D是一种精细化工产品,可用作香料,能发生如下反应:
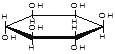
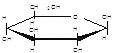
已知:Ⅰ.已知:醛与二元醇(如乙二醇)可生成环状缩醛:

请回答:
(1)D的结构简式为____________,E中含有的官能团名称为_____________。
(2)A分子中碳、氢的质量比为12︰1,A的分子式为_____________,B的结构简式为__________________________________。
(3)反应①的反应类型____________________________, 反应②的化学方程式为___________________________。
(4)兔耳草醛H中的含氧官能团易被氧化,生成化合物W, G与W可发生酯化反应,写出G与W反应的化学方程式_____________________________________________
(5)W与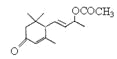 是否互为同分异构体_____(填“是”或“否”),符合下列条件的
是否互为同分异构体_____(填“是”或“否”),符合下列条件的 的同分异构体有__________种,写出其中一种的结构简式_________________________。
的同分异构体有__________种,写出其中一种的结构简式_________________________。
a.属于芳香族化合物且苯环上有五个取代基
b.核磁共振氢谱有四种类型氢原子的吸收峰
c.1mol该物质最多可消耗2molNaOH
d.能发生银镜反应
【答案】 羟基 醛基 C6H6
羟基 醛基 C6H6  加成反应或还原反应
加成反应或还原反应 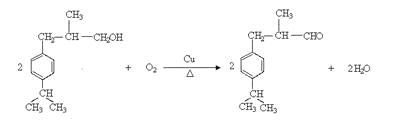
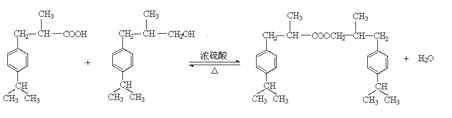 否 2
否 2 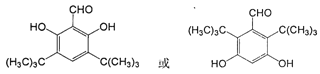
【解析】
由反应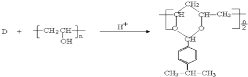 结合反应信息Ⅰ,可知D的结构简式为
结合反应信息Ⅰ,可知D的结构简式为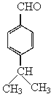 ;结合反应信息Ⅲ,逆推可得C为
;结合反应信息Ⅲ,逆推可得C为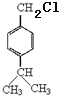 ,B为
,B为![]() ,A为
,A为![]() ;由反应信息Ⅱ,顺推可得,E为
;由反应信息Ⅱ,顺推可得,E为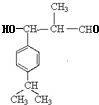 、F为
、F为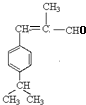 ,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G为,G中醇被氧化为-CHO,则G为
,H的相对分子质量为190,比F的相对分子质量大2,故组成上比F多2个H原子,应是F中C=C双键与氢气加成,故F中C=C、-CHO与氢气加成生成G,G为,G中醇被氧化为-CHO,则G为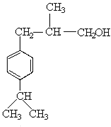 、F为
、F为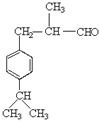 ,据此解答。
,据此解答。
(1)根据D和聚乙烯醇的反应的生成物结构简式可知,D的结构简式应该是![]() 。根据已知信息Ⅱ可知,E的结构简式是
。根据已知信息Ⅱ可知,E的结构简式是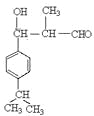 ,所以含有的官能团是醛基和羟基;
,所以含有的官能团是醛基和羟基;
(2)A分子中碳、氢的质量比为12︰1,则A分子中碳氢原子数之比是1︰1。由于D中含有苯环,所以A的分子式为C6H6。根据D的结构简式可知,B的结构简式应该是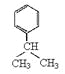 ;
;
(3)E中含有羟基,发生消去反应生成碳碳双键,即F中含有碳碳双键,所以反应①的反应类型是加成反应。又因为F中还含有醛基,所以加成后生成羟基,即G中含有羟基。由于H的相对分子质量是190,所以反应②是羟基的催化氧化反应,方程式是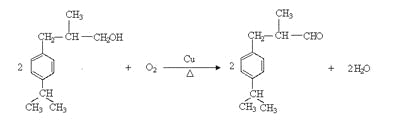 ;
;
(4)H中含有醛基,能被氧化生成羧基。而G中含有羟基,所以可以发生酯化反应,方程式是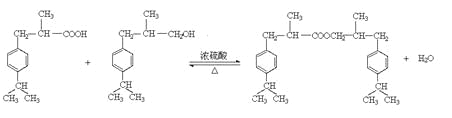 ;
;
(5)W与 分子式不同,所以二者不可能是互为同分异构体。能发生银镜反应,说明含有醛基。1mol该物质最多可消耗2molNaOH,且苯环上有五个取代基,所以应该含有的是2个酚羟基。又因为核磁共振氢谱有四种类型氢原子的吸收峰,所以可能的结构简式是
分子式不同,所以二者不可能是互为同分异构体。能发生银镜反应,说明含有醛基。1mol该物质最多可消耗2molNaOH,且苯环上有五个取代基,所以应该含有的是2个酚羟基。又因为核磁共振氢谱有四种类型氢原子的吸收峰,所以可能的结构简式是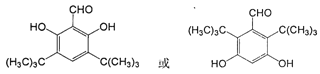 ,即共计是2种同分异构体。
,即共计是2种同分异构体。
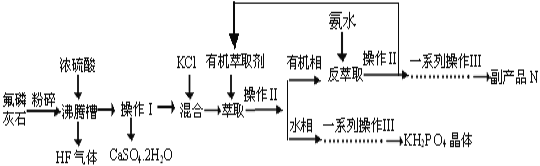
附:流程图

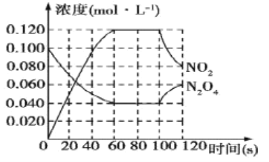
 名校课堂系列答案
名校课堂系列答案