题目内容
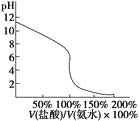
【题目】25℃时0.1molNa2CO3与盐酸混合所得体积为1L的溶液中部分微粒与溶液pH值之间关系如图所示,下列叙述正确的是
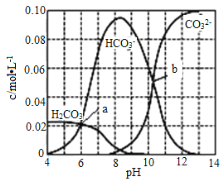
A.混合液随pH增大,![]() 先增大后减小
先增大后减小
B.b点时溶液中离子存在如下关系:2c(![]() )+c(
)+c(![]() )+c(OH-)=c(Na+)+c(H+)
)+c(OH-)=c(Na+)+c(H+)
C.H2CO3的一级电离常数Ka1约为10-6,Ka2的数量级为10-11
D.pH=7时,溶液中离子浓度大小顺序为:c(Na+)=c(Cl-)>c(![]() )>c(H+)=c(OH-)>c(
)>c(H+)=c(OH-)>c(![]() )
)
【答案】C
【解析】
A.0.1molNa2CO3与盐酸混合,根据图象,随pH增大,在溶液中出现碳酸根离子后,c(CO32-)增大,c(HCO3-)减小,因此![]() 数值增大,故A错误;
数值增大,故A错误;
B.b点所示的溶液中c(CO32-)=c(HCO3-),根据电荷守恒,2c(CO32-)+c(HCO3-)+c(OH)+c(Cl)=c(Na+)+c(H+),阴离子漏掉了氯离子,故B错误;
C.根据图象,pH=6时,c(HCO3-)=c(H2CO3),则25℃时,碳酸的第一步电离常数Ka1=![]() =c(H+)=106,b点所示的溶液中c(CO32-)=c(HCO3-),pH=10.3,则25℃时,碳酸的第二步电离常数Ka2=
=c(H+)=106,b点所示的溶液中c(CO32-)=c(HCO3-),pH=10.3,则25℃时,碳酸的第二步电离常数Ka2= ![]() =c(H+)=10-10.3=100.7×10-11,故C正确;
=c(H+)=10-10.3=100.7×10-11,故C正确;
D.pH=7,溶液中c(OH-)=c(H+),由图像知,溶液中不存在CO32-,根据电荷守恒得c(Na+)+c(H+)=c(Cl-)+c(HCO3-)+c(OH-),由c(OH-)=c(H+),则c(Na+)=c(Cl-)+c(HCO3-),所以c(Na+)> c(Cl-),故D错误;
答案为C。

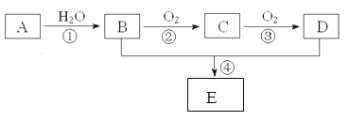
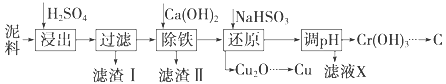
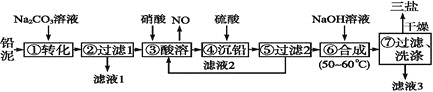
【题目】三盐![]() 可用作聚氯乙烯的热稳定剂,
可用作聚氯乙烯的热稳定剂,![]() 以上开始失去结晶水,不溶于水及有机溶剂。以铅泥
以上开始失去结晶水,不溶于水及有机溶剂。以铅泥![]() 主要成分为PbO、Pb及
主要成分为PbO、Pb及![]() 等
等![]() 为原料制备三盐的工艺流程如图所示。
为原料制备三盐的工艺流程如图所示。
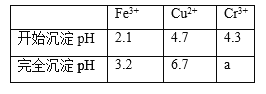
已知:![]() 和
和![]() 的溶解度和溶度积Ksp如下表。
的溶解度和溶度积Ksp如下表。
化合物 |
|
|
溶解度 |
|
|
Ksp |
|
|
(1)步骤![]() 转化的目的是___ ,滤液1中的溶质为
转化的目的是___ ,滤液1中的溶质为![]() 和____
和____![]() 填化学式
填化学式![]() 。
。
(2)步骤![]() 酸溶时,为提高酸溶速率,可采取的措施是____
酸溶时,为提高酸溶速率,可采取的措施是____![]() 任写一条
任写一条![]() 。其中铅与硝酸反应生成
。其中铅与硝酸反应生成![]() 和NO的离子方程式为_______。
和NO的离子方程式为_______。
(3)滤液2中可循环利用的溶质的化学式为____。若步骤![]() 沉铅后的滤液中
沉铅后的滤液中![]() ,则此时
,则此时![]() _____
_____![]() 。
。
(4)步骤![]() 合成三盐的化学方程式为__________________。
合成三盐的化学方程式为__________________。
【题目】今有室温下四种溶液,有关叙述不正确的是( )
① | ② | ③ | ④ | |
浓度c/mol/L | 0.1 | 0.1 | 0.1 | 0.1 |
溶液 | 氨水 | CH3COONa溶液 | 醋酸 | 盐酸 |
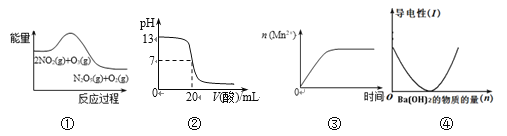
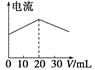
A.在20 mL ①溶液中逐滴加入③溶液,溶液导电能力变化如下图
B.②、③两溶液等体积混合,离子浓度:2c(Na+)=c(CH3COO-)+c(CH3COOH)
C.①、④两溶液等体积混合,离子浓度:c(Cl-)>c(NH4+)>c(H+)>c(OH-)
D.用④滴定①,滴定曲线如下图,可用酚酞作指示剂