【题目】某化学兴趣小组设计实验制备苯甲酸异丙酯,其原理为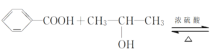
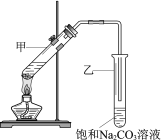
![]() ,用如图所示装置进行实验:
,用如图所示装置进行实验:
物质的部分物理性质如表所示:
物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.17 | 218 | 不溶 |
实验步骤:
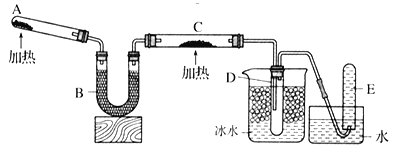
步骤Ⅰ.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;
步骤Ⅱ.加热至70℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:
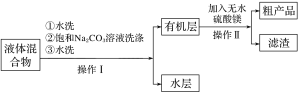
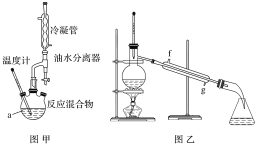
步骤Ⅳ.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后顺序一定错误的是___(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___。加入的苯甲酸和异丙醇中,一般使异丙醇稍过量,目的是___。
(3)本实验一般采用水浴加热,因为温度过高会使产率___(填“增大”“减小”或“不变”)。
(4)步骤III的操作Ⅰ中第二次水洗的目的是__,操作Ⅱ中加入无水硫酸镁的作用为___。
(5)步骤Ⅳ操作时应收集218℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___(填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为___%(结果保留2位有效数字)。
【题目】氮及其化合物如NH3及铵盐、N2H4、N2O4等在中学化学、化工工业、国防等领域占有重要地位。
(1)发射航天火箭常用肼(N2H4)与N2O4作燃料与助燃剂。肼(N2H4)与N2O4的反应为
2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H=-1077 kJ·mol-1。
已知相关反应的化学键键能数据如下表所示:
化学键 | N-H | N-N |
| O-H |
E/(kJ·mol-1) | 390 | 190 | 946 | 460 |
①使1 mol N2O4(g)分子中化学键完全断裂时需要吸收的能量是________________。
②下列能说明2N2H4 (g)+ N2O4(g)==3N2(g)+4H2O(g) △H 达平衡状态的是________
a.混合气体的平均相对分子质量不变 b.V(N2)=3V( N2O4)
c.N2H4的质量保持不变 d. △H不再变化
(2)N2O4与NO2之间存在反应N2O4(g) ![]() 2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。
2NO2(g)。将一定量的N2O4放人恒容密闭容器中,测得其平衡转化率[α(N2O4)]随温度的变化如下图所示。

①由图推测该反应的△H_______0(填>”或“<”),理由为____________________________。
②图中a点对应温度下,已知N2O4的起始压强p0为108 kPa,则该温度下反应的平衡常数Kp=________________ (用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)电解NO2制备NH4NO3,其工作原理如下图所示。

①阴极的电极反应式为____________________________________________________。
②为使电解产物全部转化为NH4NO3,需补充某种化合物——物质A,则A的化学式为________________。