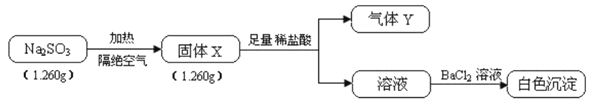
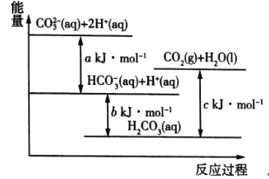
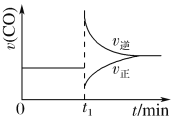
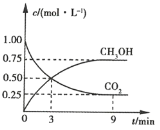
题目内容
【题目】实验研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低。现有一定量的铝粉和铁粉的混合物与一定量很稀的硝酸充分反应,反应过程中无气体放出。在反应结束后的溶液中逐滴加入![]() 溶液,所加NaOH溶液的体积
溶液,所加NaOH溶液的体积![]() 与产生沉淀的物质的量
与产生沉淀的物质的量![]() 关系如下图所示,下列说法不正确的是
关系如下图所示,下列说法不正确的是 ![]()
![]()

A.稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵
B.c点对应溶液的体积为![]()
C.b点与a点的差值为![]()
D.样品中铝粉和铁粉的物质的量之比为![]()
【答案】B
【解析】
铝粉和铁粉的混合物与一定量很稀![]() 充分反应,被氧化为
充分反应,被氧化为![]() 、
、![]() ,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由
,通过题意,反应始终没有气体生成,可以得出不会有氮的氧化物生成,又有硝酸的浓度越稀,对应还原产物中氮元素的化合价越低,可以推测N元素由![]() 变成了
变成了![]() 价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与
价,由图可得硝酸过量,加入氢氧化钠溶液应先与硝酸反应,再生成沉淀,当沉淀完全后,由图知继续加入氢氧化钠溶液,沉淀量不变,可得与![]() 发生了反应,则随着NaOH的滴加,发生的反应依次有:
发生了反应,则随着NaOH的滴加,发生的反应依次有: ![]() ,
,![]() ,
,![]() ,
,![]() ,
,![]() , b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为
, b与a的差值为氢氧化铝的物质的量,由图可知,ef段消耗的氢氧化钠溶液为104mL-94mL=10mL,故该阶段参加反应的氢氧化钠为![]() ,根据
,根据![]() 可知,
可知,![]() 的物质的量为
的物质的量为![]() ,根据铝元素守恒,故混合金属中
,根据铝元素守恒,故混合金属中![]() , 由图可知,de段消耗的氢氧化钠的体积为
, 由图可知,de段消耗的氢氧化钠的体积为![]() ,故该阶段参加反应的氢氧化钠为
,故该阶段参加反应的氢氧化钠为![]() ,根据
,根据![]() 可知,计算溶液中
可知,计算溶液中![]() ,根据电子转移守恒有,
,根据电子转移守恒有,![]() ,即
,即![]() ,解得
,解得![]() , 由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,
, 由反应过程可知,到加入氢氧化钠为88mL时,溶液中溶质为硝酸钠与硝酸铵,![]() ,根据钠元素守恒,可知
,根据钠元素守恒,可知![]() ,根据氮元素守恒计算原硝酸溶液中
,根据氮元素守恒计算原硝酸溶液中![]() ,而c点溶液为
,而c点溶液为![]() 、
、![]() 、
、![]() 、
、![]() ,根据氮元素守恒
,根据氮元素守恒![]() ,故c点溶液中
,故c点溶液中![]() ,故c点加入NaOH的物质的量
,故c点加入NaOH的物质的量![]() ,据此解答;
,据此解答;
A.由上述分析可知,稀硝酸与铝粉、铁粉反应,其还原产物为硝酸铵,故A正确;
B.由上述分析可知,c点对应NaOH溶液的体积![]() ,故B错误;
,故B错误;
C.由上述分析可知,b与a的差值![]() ,故C正确;
,故C正确;
D.由上述分析可知,混合金属中![]() 、
、![]() ,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;
,样品中铝粉和铁粉的物质的量之比为5:3,故D正确;
故答案为B。

【题目】下列实验操作、现象和结论均正确的是
操作 | 可能的实验现象 | 解释 | |
A | 用硫酸做催化剂的淀粉水解液中,加入新制的Cu(OH)2悬浊液,加热 | 有红色沉淀生成 | 葡萄糖含醛基 |
B | 向酚酞溶液中加入足量Na2O2 | 溶液先变红后褪色 | Na2O2与水生成的碱有漂白性 |
C | 将已氧化的Cu丝从酒精灯的外焰慢慢移向内焰 | 黑色的Cu丝变红 | CuO被内焰中的乙醇蒸气还原 |
D | 向饱和Na2CO3溶液中通入CO2 | 有晶体析出 | 溶解度:Na2CO3>NaHCO3 |
A.AB.BC.CD.D
【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应