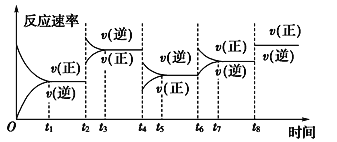
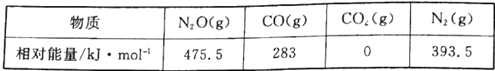
题目内容
【题目】莽草酸可用于合成药物达菲,其结构简式如图,下列关于莽草酸的说法正确的是
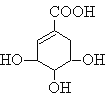
A.分子式为C7H6O5
B.分子中含有2种官能团
C.可发生加成和取代反应
D.在水溶液羧基和羟基均能电离出H+
【答案】C
【解析】
A、分析莽草酸的结构简式可知其分子式为:C7H10O5,A错误;
B、其分子中含有羧基、碳碳双键和醇羟基三种官能团,B错误;
C、其结构中的碳碳双键能发生加成反应、羧基和醇羟基均发生酯化反应和取代反应,C正确;
D、莽草酸中的羟基是醇羟基,其不能在水溶液中电离出氢离子,D错误。答案选C。
类别 | 脂肪醇 | 芳香醇 | 酚 |
官能团 | 醇羟基 | 醇羟基 | 酚羟基 |
结构特点 | -OH与链烃基相连 | -OH与苯环上的侧链相连 | -OH与苯环直接相连 |
羟基上H的活泼性 | 能与金属钠反应,但比水弱,不能与NaOH、Na2CO3溶液反应 | 有弱酸性,能与NaOH、Na2CO3溶液反应,但不能与NaHCO3溶液反应 | |
原因 | 烃基对羟基的影响不同,烷基使羟基上H的活泼性减弱,苯基使羟基上H的活泼性增强 | ||

 名校课堂系列答案
名校课堂系列答案【题目】某化学兴趣小组设计实验制备苯甲酸异丙酯,其原理为
![]() ,用如图所示装置进行实验:
,用如图所示装置进行实验:

物质的部分物理性质如表所示:
物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.17 | 218 | 不溶 |
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;
步骤Ⅱ.加热至70℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:

步骤Ⅳ.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后顺序一定错误的是___(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___。加入的苯甲酸和异丙醇中,一般使异丙醇稍过量,目的是___。
(3)本实验一般采用水浴加热,因为温度过高会使产率___(填“增大”“减小”或“不变”)。
(4)步骤III的操作Ⅰ中第二次水洗的目的是__,操作Ⅱ中加入无水硫酸镁的作用为___。
(5)步骤Ⅳ操作时应收集218℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___(填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为___%(结果保留2位有效数字)。