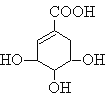
题目内容
【题目】某化学兴趣小组设计实验制备苯甲酸异丙酯,其原理为
![]() ,用如图所示装置进行实验:
,用如图所示装置进行实验:

物质的部分物理性质如表所示:
物质 | 相对分子质量 | 密度/g·cm-3 | 沸点/℃ | 水溶性 |
苯甲酸 | 122 | 1.27 | 249 | 微溶 |
异丙醇 | 60 | 0.79 | 82 | 易溶 |
苯甲酸异丙酯 | 164 | 1.17 | 218 | 不溶 |
实验步骤:
步骤Ⅰ.在干燥的仪器a中加入38.1g苯甲酸、30mL异丙醇和15mL浓硫酸,再加入几粒沸石;
步骤Ⅱ.加热至70℃左右,保持恒温半小时;
步骤Ⅲ.将仪器a中液体进行如下所示操作得到粗产品:

步骤Ⅳ.将粗产品用图乙所示装置进行精制。
试回答下列问题:
(1)步骤Ⅰ中加入三种试剂的先后顺序一定错误的是___(填字母)。
A.异丙醇、苯甲酸、浓硫酸
B.浓硫酸、异丙醇、苯甲酸
C.异丙醇、浓硫酸、苯甲酸
(2)图甲中仪器a的名称为___。加入的苯甲酸和异丙醇中,一般使异丙醇稍过量,目的是___。
(3)本实验一般采用水浴加热,因为温度过高会使产率___(填“增大”“减小”或“不变”)。
(4)步骤III的操作Ⅰ中第二次水洗的目的是__,操作Ⅱ中加入无水硫酸镁的作用为___。
(5)步骤Ⅳ操作时应收集218℃的馏分,如果温度计水银球偏上,则收集的精制产品中可能混有的杂质为___(填物质名称)。
(6)如果得到的苯甲酸异丙酯的质量为40.930g,则该实验的产率为___%(结果保留2位有效数字)。
【答案】B 三颈烧瓶 有利于酯化反应向正反应方向进行,提高苯甲酸的转化率 减小 除去残留的碳酸钠 除去残留的水 苯甲酸 80
【解析】
由题中信息可知,苯甲醇和异丙醇在浓硫酸的催化下发生酯化反应生成苯甲酸异丙酯。得到的粗产品经水洗、饱和碳酸钠溶液洗涤、再水洗后,分液,有机层经无水硫酸镁干燥,过滤,滤液经蒸馏得到较纯的产品。
(1) 浓硫酸密度大,且具有强氧化性,在此反应中浓硫酸作催化剂,所以不能先加,故先后顺序一定错误的是B,故答案为:B;
(2) 根据图示仪器构造分析A为三颈烧瓶;该反应为可逆反应,使异丙醇稍过量有利于酯化反应向正反应方向进行,提高苯甲酸的转化率;
(3) 异丙醇沸点低,易挥发损耗,所以温度过高会使产率减小,故答案为:减小;
(4) 苯甲酸微溶于水,所以用饱和碳酸钠溶液洗,然后第二次水解的目的是除去残留的碳酸钠;再加入无水硫酸镁是为了除去残留的水,故答案为:除去残留的碳酸钠;除去残留的水;
(5) 如果温度计水银球偏上,则使得蒸馏烧瓶内蒸汽温度升高,达到苯甲酸的沸点时,此时收集的精制产品中可能混有的杂质为苯甲酸,故答案为:苯甲酸;
(6)38.1g苯甲酸的物质的量为![]() ,30mL异丙醇的物质的物质的量为
,30mL异丙醇的物质的物质的量为![]() ,则醇过量,理论上得到苯甲酸异丙酯的物质的量为0.31mol则产率为
,则醇过量,理论上得到苯甲酸异丙酯的物质的量为0.31mol则产率为![]() ,故答案为80。
,故答案为80。

 轻松暑假总复习系列答案
轻松暑假总复习系列答案【题目】经测定乙醇的分子式是C2H6O,由于有机化合物普遍存在同分异构现象,推测乙醇分子的结构可能是下列两种之一:
Ⅰ. Ⅱ.
Ⅱ.
为确定其结构,应利用物质的特殊性质进行定性、定量实验。现给出乙醇、钠、水及必要的仪器,甲、乙、丙三名学生利用如图所示装置进行实验确定乙醇分子的结构。图中量气装置由甲、乙两根玻璃管组成,它们用橡皮管连通,并装入适量水。甲管有刻度(0~200mL),供量气用;乙管可上下移动,以调节液面高低。

(1)学生甲得到一组实验数据;
乙醇的物质的量 | 氢气的体积(标准状况下) |
0.01mol | 0.112L |
根据以上数据推断,乙醇的结构应为___(填“Ⅰ”或“Ⅱ”),原因是___。
(2)学生乙认为:为了较准确地测量氢气的体积,除了必须检查整个装置的气密性外,在读取反应前后甲管中液面读数的过程中,应注意___(填序号)。
a.视线与凹液面最低处相平
b.等待片刻,待乙管中液面不再上升时,立刻读数
c.读数时应上下移动乙管,使甲、乙两管液面相平
d.读数时不一定使甲、乙两管液面相平
(3)学生丙不想通过称取乙醇的质量来确定乙醇的物质的量,那么他还需要知道的数据是___。