【题目】某学生用NaHCO3和KHCO3组成的某混合物进行实验,测得如下数据(盐酸的物质的量浓度相等),下列分析推理正确的是
50mL盐酸 | 50mL盐酸 | 50mL盐酸 | |
m(混合物) | 9.2g | 15.7g | 27.6g |
| 2.24L | 3.36L | 3.36L |
A.盐酸的物质的量浓度为5.0mol·L-1
B.根据表中数据计算出混合物中NaHCO3的物质的量分数为50%
C.9.2g混合物中NaHCO3和KHCO3分别为5.0g和4.2g
D.15.7g混合物恰好与盐酸完全反应
【题目】草酸(H2C2O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
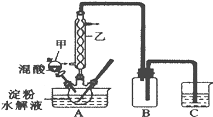
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,然后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是__。
(2)如何检验该装置的气密性:__。
(3)要控制反应温度55~60℃,应选择加热的方式是__,C装置中应加入__溶液。
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:___。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是__。
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液放入锥形瓶中,将0.10mol/L酸性KMnO4溶液装在__(填仪器名称)中进行滴定,达到滴定终点时的现象是__。若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为__。
【题目】下列实验中所用的试剂、仪器或用品![]() 夹持装置、活塞省去
夹持装置、活塞省去![]() 能够达到该目的是( )
能够达到该目的是( )
选项 | 目的 | 试剂 | 仪器或用品 |
A | 验证牺牲阳极的阴极保护 | 酸化NaCl溶液、Zn电极、Fe电极、铁氰化钾 | 烧杯、电压表、导线、胶头滴管 |
B | 铝热反应 | 氧化铁、铝粉 | 滤纸、酒精灯、木条、盛沙子的蒸发皿 |
C | 配制1.000mol/LNaCl | NaCl | 容量瓶、烧杯、玻璃棒、试剂瓶 |
D | 制备乙酸乙酯 | 乙醇、乙酸、饱和碳酸钠 | 大小试管、酒精灯 |
A.AB.BC.CD.D
【题目】下列说法正确的是(________)
A.化学反应在物质变化的同时,伴随着能量变化,其表现形式只有吸热和放热两种
B.同温同压下,反应H2(g)+Cl2(g)=2HCl(g)在光照和点燃条件下的ΔH不同
C.由“C(s,石墨)=C(s,金刚石) ΔH=+1.9kJ·mol-1”可知,金刚石比石墨稳定
D.“冰,水为之,而寒于水”说明相同质量的水和冰相比较,冰的能量高
E.相同条件下,如果1mol氢原子所具有的能量为E1,1mol氢分子的能量为E2。则2E1>E2
F.测定盐酸和氢氧化钠反应的中和热实验中,所用试剂可以是浓溶液
G.1molNaOH分别和1molCH3COOH、1molHNO3反应放出的热量:CH3COOH<HNO3
H.把铝条放入盛有过量稀盐酸的试管中,加入Na2SO4溶液不影响氢气产生速率
I.对于可逆反应,反应进行的净速率是正、逆反应速率之差
J.对于可逆反应,正、逆反应速率的比值是恒定的
K.探究温度对反应速率的影响时,应先将硫代硫酸钠溶液、硫酸溶液分别在水浴中加热,然后混合
L.已知:
共价键 | C-C | C=C | C-H | H-H |
键能/kJ·mol-1 | 348 | 610 | 413 | 436 |
则可以计算出反应![]() (g)+3H2(g)→
(g)+3H2(g)→![]() (g)的ΔH为-384kJ·mol-1
(g)的ΔH为-384kJ·mol-1