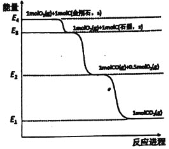
题目内容
【题目】某一定量的锌与稀硫酸反应,收集到4.48L氢气(标准状况)。
(1)计算参加反应的锌的质量是多少?__________
(2)若所用稀硫酸的浓度为0.4mol/L,则至少需要硫酸溶液的体积为多少升?__________
【答案】13g 0.5L
【解析】
锌与稀硫酸反应的方程式是![]() ,根据化学方程式计算。
,根据化学方程式计算。
4.48L氢气(标准状况)的物质的量是![]() 0.2mol;
0.2mol;
设参加反应的锌的物质的量是xmol,消耗硫酸的物质的量是ymol;
![]()
1 1 1
x y 0.2
![]()
x=0.2mol,y=0.2mol,
(1)参加反应的锌的质量是0.2mol ×65g/mol=13g
(2)若所用稀硫酸的浓度为0.4mol/L,则至少需要硫酸溶液的体积为![]() =0.5L。
=0.5L。

 智趣寒假作业云南科技出版社系列答案
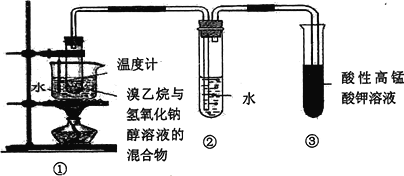
智趣寒假作业云南科技出版社系列答案【题目】草酸(H2C2O4)是一种重要的有机化工原料,为探究草酸的制取和草酸的性质,进行如下实验。
实验Ⅰ:实验室用硝酸氧化淀粉水解液法制备草酸,装置如图所示:
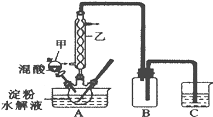
①一定量的淀粉水解液加入三颈烧瓶中
②控制反应温度55~60℃,边搅拌边缓慢滴加一定量的混合酸(65%的H2SO4与98%的H2SO4的质量比2:1.25)
③反应3小时,冷却,然后再重结晶得到草酸晶体
硝酸氧化淀粉水解液的反应为:C6H12O6+12HNO3=3H2C2O4+9NO2↑+3NO↑+9H2O
(1)装置B的作用是__。
(2)如何检验该装置的气密性:__。
(3)要控制反应温度55~60℃,应选择加热的方式是__,C装置中应加入__溶液。
实验Ⅱ:探究草酸与酸性高锰酸钾的反应
(4)向草酸溶液中逐滴加硫酸酸化的高锰酸钾溶液时,可观察到溶液由紫红色变为近乎无色,写出上述反应的离子方程式:___。
(5)学习小组的同学发现,当向草酸溶液中逐滴加入硫酸酸化的高锰酸钾溶液时,溶液褪色总是先慢后快,为探究其原因,同学们做了如下对比实验:
实验序号 | H2C2O4(aq) | KMnO4(H+)(aq) | MnSO4(s) 质量(g) | 褪色时间(g) | ||
c(mol·L-1) | V(mL) | c(mol·L-1) | V(mL) | |||
实验1 | 0.1 | 2 | 0.01 | 4 | 0 | 30 |
实验2 | 0.1 | 2 | 0.01 | 4 | 5 | 4 |
由此你认为溶液褪色总是先慢后快的原因是__。
(6)为测定上述实验中得到草酸的纯度,取5.0g该草酸样品,配制成250mL溶液,然后取25.00mL此溶液放入锥形瓶中,将0.10mol/L酸性KMnO4溶液装在__(填仪器名称)中进行滴定,达到滴定终点时的现象是__。若消耗酸性KMnO4溶液体积为20.00mL,则该草酸样品的纯度为__。