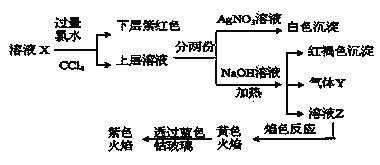
��Ŀ����
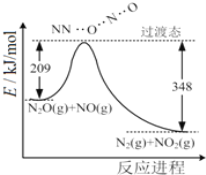
����Ŀ����1����N2O��NO��Ӧ����N2��NO2�������仯��ͼ��ʾ��������1molN2�����H=___kJ��mol-1��
��2����֪����C(s)+O2(g)=CO2(g) ��H=akJ��mol-1
��CO2(g)+C(s)=2CO(g) ��H=bkJ��mol-1
��Si(s)+O2(g)=SiO2(s) ��H=ckJ��mol-1
��ҵ�������ֹ���Ȼ�ѧ����ʽΪ__��
��3������������ȥ��2����ԭ���γ�һ��˫�������ȷ�Ӧ����Լ��117kJ/mol��125kJ/mol����������1��3��������ϩʧȥ2����ԭ�ӱ�ɱ��Ƿ��ȷ�Ӧ����H=-23.4kJ/mol��������ʵ�������������ɻ�������__��Ӧ��������Ȼ����ȣ�
��4��X��Y��Ԫ�ص�ԭ�ӣ������Ƿֱ������������γ�ϡ������Ԫ�ص��Ӳ�ṹʱ��X�ų�����������Y�ų���������Z��W��Ԫ�ص�ԭ�ӣ������Ƿֱ�ʧȥһ�������γ�ϡ������Ԫ��ԭ�ӵĵ��Ӳ�ṹʱ����������W����Z����X��Y��Z��W�ֱ��γɵĻ������У����ӻ����������������__���������Ļ�ѧʽ��
��5����ȡ������Ϊ(ag)�������ݡ���һ������bgˮ�У���֪���ܽ�ʱ����Q1kJ����������һ����ˮ������bgˮ�У�������ܽ�ʱ����Q2kJ�����������ݿ�֪��1mol������ˮ��__kJ������
���𰸡�-139 2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ��H=��2a+b-c��kJ��mol-1 ���� Z2X ![]()
��������
(1)��ͼʾ��֪��Ӧ����1mol����Ϊ���ȹ��̣��ų�������Ϊ348kJ-209kJ=139kJ����Ӧ����H=-139 kJ��mol-1���ʴ�Ϊ��-139��
(2) ��ҵ�ƴֹ�ķ�ӦΪ��2C(s)+ SiO2(s)= Si(s)+ 2CO(g)���ɸ�˹���ɿ�֪���÷�Ӧ=![]() ������H=��2a+b-c��kJ��mol-1���Ȼ�ѧ����ʽΪ��2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ��H=��2a+b-c��kJ��mol-1���ʴ�Ϊ��2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ��H=��2a+b-c��kJ��mol-1��
������H=��2a+b-c��kJ��mol-1���Ȼ�ѧ����ʽΪ��2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ��H=��2a+b-c��kJ��mol-1���ʴ�Ϊ��2C(s)+ SiO2(s)= Si(s)+ 2CO(g) ��H=��2a+b-c��kJ��mol-1��
(3)�������֪��![]() ���ɻ�����ת��ɱ��������������������ģ����ɱ���������Ĺ���Ϊ���ȹ��̣��ʴ�Ϊ�����ȡ�
���ɻ�����ת��ɱ��������������������ģ����ɱ���������Ĺ���Ϊ���ȹ��̣��ʴ�Ϊ�����ȡ�
(4) X��Y��Ԫ�ص�ԭ�ӣ������Ƿֱ������������γ�ϡ������Ԫ�ص��Ӳ�ṹʱ��X�ų�����������Y�ų�������,˵��X��Y����Ҫ�ߣ�X��Y���ã�Z��W��Ԫ�ص�ԭ�ӣ������Ƿֱ�ʧȥһ�������γ�ϡ������Ԫ��ԭ�ӵĵ��Ӳ�ṹʱ����������W����Z��˵��W��Z��ʧ���ӣ���Z��W���ã����õĽ���Ԫ������õķǽ���Ԫ�ظ����γ����Ӽ������ӻ����������������Z2X���ʴ�Ϊ��Z2X��
(5)�����⣺ag��������bgˮ�У�����Q1kJ��������1mol�����ܽ�����Ϊ��![]() ,���ܽ�ʱ���Ȼ�ѧ����ʽΪ��
,���ܽ�ʱ���Ȼ�ѧ����ʽΪ��![]() ����ˮ������bgˮ�У�������ܽ�ʱ����Q2kJ�ɵ�
����ˮ������bgˮ�У�������ܽ�ʱ����Q2kJ�ɵ�![]() ��1mol������ˮ���Ȼ�ѧ����ʽΪ��
��1mol������ˮ���Ȼ�ѧ����ʽΪ��![]() ���ɸ�˹���ɿɵã�
���ɸ�˹���ɿɵã�![]() ����1mol������ˮ������
����1mol������ˮ������![]() ���������ʴ�Ϊ��
���������ʴ�Ϊ��![]() ��
��

����Ŀ���±��Dz�ͬ�¶��µ����ӻ����ݣ�
�¶�(��) | 25 | t1 | t2 |
ˮ�����ӻ����� | 1��10-14 | �� | 1��10-12 |
�Իش��������⣺
(1)��25<t1<t2������____(����>������>������=��)1��10��14���������жϵ�������______��
(2)��t1ʱ����ô�ˮ�е�c(H��)=2.4��10��7mol/L����c(OH-)Ϊ______�����¶��£����ijH2SO4��Һ��c(SO42-)=5��10��6 mol��L��1������Һ��c(OH-)=__mol/L��
(3)��һ�����£�CH3COOH��Һ�д��ڵ���ƽ�⣺CH3COOH![]() CH3CH3COO��+H+ ��H>0�����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������__��
CH3CH3COO��+H+ ��H>0�����з����У�����ʹ0.10mol��L��1CH3COOH��Һ��CH3COOH����̶��������__��
a.��������0.10mol��L��1��ϡ���� b.����
c.��ˮϡ����0.010mol/L d.��������������
e.���������Ȼ��ƹ��� f.��������0.10mol��L��1��NaOH��Һ
(4)c(H+)��ͬ�ĵ������������ҺCH3COOH��HCl���ֱ���������п�۷�Ӧ��������˵����ȷ����__(��д���)
a.��Ӧ����Ҫ��ʱ��CH3COOH>HCl
b.��ʼ��Ӧʱ������HCl>CH3COOH
c.�μӷ�Ӧ��п�����ʵ����������
d.CH3COOH���ĵ�п�۵���������