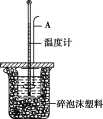
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
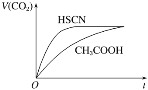
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。