题目内容
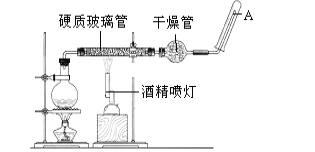
【题目】某化学兴趣小组的同学利用下图所示实验装置进行实验(图中a、b、c表示止水夹)。

(1)利用B装置可制备的气体有________________(写出一种即可)。
(2)若装置A、C、E相连后用于制取Cl2,写出A中发生的离子方程式_____________。 若要收集到纯净干燥的氯气,需要在装置A、C之间增加两个装有____________和_______的洗气瓶(填写试剂的名称)。
(3)若装置A、C、E相连后用于制取SO2,尾气吸收时容易发生倒吸现象,改进措施为__________________________。
(4)若装置B、D、E相连后可制得NO2并进行有关实验。欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹____________,再打开止水夹_____________,微热试管丁使烧杯中的水进入丁中,充分反应后,若向试管中通入一定量的氧气至试管内完全充满液体,则所得溶液中溶质的物质的量浓度是__________________ mol/L(气体按标准状况计算)。
【答案】H2、CO2、NO、NO2等(合理答案皆可) MnO2+4H+ +2Cl- ![]() Mn2++Cl2↑ +2H2O 饱和食盐水 浓硫酸 液面上倒扣一个漏斗 a、b c 0.045
Mn2++Cl2↑ +2H2O 饱和食盐水 浓硫酸 液面上倒扣一个漏斗 a、b c 0.045
【解析】
(1)B装置为块状不溶于水的固体和液体反应不加热制取气体的装置;
(2)实验室用MnO2与浓盐酸混合加热制取氯气,Cl2密度大用向上排空气方法收集;氯气是有毒气体,要进行尾气处理;浓盐酸有挥发性,制取的氯气中含有杂质HCl、水蒸气,要在A、C间增加除HCl、除水蒸气的装置;
(3)SO2易溶于NaOH溶液,为防止倒吸现象的发生,可在导气管末端安装一个倒扣的漏斗;
(4)浓硝酸具有强氧化性,与铜反应生成二氧化氮气体;Cu片与浓硝酸反应制取NO2气体,根据NO2容易溶于水分析,结合反应4NO2+O2+2H2O=4HNO3计算所得硝酸溶液的物质的量浓度。
(1)B装置为块状不溶于水的固体和液体反应制取气体的装置,反应不需要加热,中学化学中常见的有:H2、CO2、NO、NO2、H2S等;
(2)在装置A中浓盐酸与MnO2混合加热制取Cl2,反应方程式为:MnO2+4H+ +2Cl- ![]() Mn2++Cl2↑ +2H2O;实验室制得的氯气中有杂质气体HCl和水蒸气,若要收集到纯净干燥的氯气,需要在装置A、C之间增加两个装置,一个装置盛有饱和食盐水,用来除去HCl杂质,另一个装置盛有浓硫酸用来除去水蒸气,干燥Cl2;
Mn2++Cl2↑ +2H2O;实验室制得的氯气中有杂质气体HCl和水蒸气,若要收集到纯净干燥的氯气,需要在装置A、C之间增加两个装置,一个装置盛有饱和食盐水,用来除去HCl杂质,另一个装置盛有浓硫酸用来除去水蒸气,干燥Cl2;
(3)若装置A、C、E相连后用于制取SO2,A制取SO2,C收集SO2,由于SO2是有毒气体,用装置E进行尾气处理,为防止尾气吸收时发生倒吸现象,改进措施是在导气管末端安装一个倒扣漏斗,使漏斗边沿在液面上或连接一个干燥管;
(4)若装置B、D、E相连后可制得NO2并进行有关实验。B中Cu与浓硝酸反应制取NO2,D收集NO2,E是尾气处理装置,欲用D装置验证NO2与水的反应,其操作步骤为:先关闭止水夹a、b,再打开止水夹c,微热试管丁,使烧杯中的水进入丁中。充分反应后,若向试管中通入一定量的氧气,发生反应:4NO2+O2+2H2O=4HNO3,至试管内完全充满液体。假设试管的容积为VL,则试管中盛有NO2气体在标准状况下的体积也就是VL,n(NO2)=![]() ,根据N元素守恒,可得n(HNO3)=n(NO2)=
,根据N元素守恒,可得n(HNO3)=n(NO2)=![]() ,溶液的体积为VL,则所得溶液中溶质HNO3的物质的量浓度是c(HNO3)=
,溶液的体积为VL,则所得溶液中溶质HNO3的物质的量浓度是c(HNO3)=![]() 0.045mol/L。
0.045mol/L。

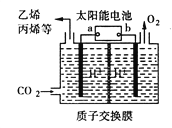
【题目】一氧化碳、二氧化碳的利用具有十分重要的意义,科学家提出以下几个设想:
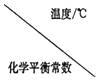
Ⅰ.二氧化碳与氢气在催化剂作用下可制取低碳烯烃。在一恒容密闭容器中分别投入1molCO2、3molH2,发生反应:2CO2(g)+6H2(g)![]() C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
C2H4(g)+4H2O(g) △H;在不同温度下,用传感技术测出平衡时H2的物质的量变化关系如图所示。
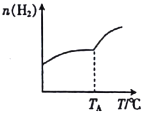
(1)其他条件不变,起始时若按1molCO2、2molH2进行投料,则CO2的转化率将____________(填“增大”“ 减小”或“不变”)。
(2)△H____________ (填“>”“<”或“不能确定”)0。
(3)若测试中体系内无氧气产生,试结合图示推断热稳定性:C2H4_______(填“>” “<”或“不能确定”)H2O。
Ⅱ.甲醇是重要的化工原料,又可作为燃料,工业上可利用CO或CO2来生产燃料甲醇。已知制备甲醇的有关反应的化学方程式以及在不同温度下的化学平衡常数如下表所示。
化学反应 |
| 500 | 700 | 800 |
①2H2(g)+CO(g) | K1 | 2.5 | 0.34 | 0.15 |
②H2(g)+CO2(g) | K2 | 1.0 | 1. 70 | 2.52 |
③3H2(g)+CO2 (g) | K3 |
请回答下列问题:
(4)根据反应比较△H1__________(填“>”“ <”或“不确定”)△H2。
(5)500℃时测得反应③在某时刻H2(g)、CO2
(6)下列措施能使反应③的平衡体系中![]() 增大的是___________(填字母)。
增大的是___________(填字母)。
A.将H2O(g)从体系中分离出去 B.充入He(g),使体系压强增大
C.升高温度 D.再充入1molH2
Ⅲ.(7)有人设想将CO按下列反应除去:2CO(g)=2C(s)+O2(g),请你分析该设想能否实现?_______________(填“能”或“不能”),依据是__________________。
【题目】镧系为元素周期表中第ⅢB族、原子序数为57~71的元素。
(1)镝(Dy)的基态原子电子排布式为[Xe]4f106s2,画出镝(Dy)原子外围电子排布图:___________。
(2)高温超导材料镧钡铜氧化物中含有Cu3+,基态时Cu3+ 的电子排布式为________________。
(3)观察下面四种镧系元素的电离能数据,判断最有可能显示+3 价的元素是___________(填元素名称)。几种镧系元素的电离能(单位:kJ mol-1)
元素 | I1 | I2 | I3 | I4 |
Yb(镱) | 604 | 1217 | 4494 | 5014 |
Lu(镥) | 532 | 1390 | 4111 | 4987 |
La(镧) | 538 | 1067 | 1850 | 5419 |
Ce(铈) | 527 | 1047 | 1949 | 3547 |
(4)元素铈(Ce)可以形成配合物(NH4)2[Ce(NO3)6]。
①组成配合物的四种元素,电负性由大到小的顺序为________________(用元素符号表示)。
②写出氮的最简单气态氢化物水溶液中存在的氢键:__________________(任写一种)。
③元素Al 也有类似成键情况,气态氯化铝分子表示为(AlCl3)2,分子中Al 原子杂化方式为_____________,分子中所含化学键类型有______________(填字母)。
a.离子键 b.极性键 C.非极性键 d.配位键
(5)PrO2(二氧化镨)的晶体结构与CaF2相似,晶胞中镨原子位于面心和顶点,则PrO2(二氧化镨)的晶胞中有________个氧原子;已知晶胞参数为a pm,密度为ρ g· cm-3,NA=_____________ (用含a、ρ的代数式表示)。
【题目】为了提纯下列物质(括号内为杂质),所选用的除杂试剂、分离方法、必用仪器均正确的是( )
选项 | 不纯物质(杂质) | 除杂试剂或分离方法 | 必用仪器 |
A | 碘水 | 酒精、萃取 | 分液漏斗 |
B | 二氧化碳(一氧化碳) | 点燃 | |
C | 硝酸钾(氯化钠) | 直接蒸发结晶 | 蒸发皿 |
D | 乙醇(水) | 生石灰、蒸馏 | 蒸馏烧瓶 |
A.AB.BC.CD.D