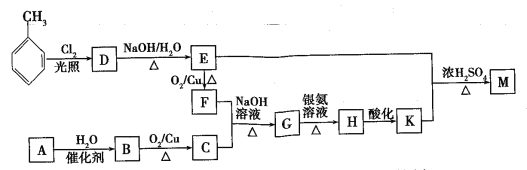
题目内容
【题目】
Ⅰ.对于可逆反应CO+H2O(g)![]() CO2+H2,回答下列问题:
CO2+H2,回答下列问题:
(1)830 K时,若起始时c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,水蒸气的转化率为 _____________;平衡常数K的值为 _____________。
(2)830 K时,若只将起始时c(H2O)改为6 mol·L-1,则水蒸气的转化率为_____________ 。
(3)若830 K时,某时刻混合体系中各气体的浓度为c(CO2)=0.4 mol·L-1c(CO)=0.6 mol·L-1c(H2O)=3 mol·L-1,c(H2)=2 mol·L-1请判定该体系中反应进行的方向:______________ (填“正向进行”“逆向进行”或“达到平衡”)。
Ⅱ恒温恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g) ![]() C(g)
C(g)
(1)若开始时放入1mol A和1mol B,达到平衡后,生成a mol C,这时A的物质的量为 _______ mol。
(2)若开始时放入3mol A和3mol B,达到平衡后,生成C的物质的量为 _______mol。
(3)若开始时放入x mol A2mol B和1mol C,达到平衡后,A和C的物质的量分别为y mol和3a mol,则x= ______,y= _________。
(4)若在(3)的平衡混合物中再加入3mol C,待再次达到平衡后,C的物质的量分数是 _______。
【答案】40% 1 25% 正向进行 1-a 3a 2 3-3a ![]()
【解析】
Ⅰ.(1)根据CO的起始浓度和转化率可以计算CO的转化浓度,列三段式求出平衡时各物质的物质的量浓度,从而计算水蒸气的转化率和平衡常数K;
(2)设CO的转化浓度为x,列出三段式,根据一定温度下反应的平衡常数不变解出x,据此分析;
(3)计算此时反应的浓度商,并与平衡常数进行比较判断反应进行的方向。
Ⅱ.(1)依据化学平衡的三段式列式计算;
(2)根据恒温、恒压下放入3molA和3molB,与(1)建立等效平衡进行分析;
(3)恒温、恒压下根据生成的C为3a mol可知,达到的平衡与起始量加入3molA、3molB所达到的平衡是相同的平衡,依据(2)的分析计算得到(3)的X、Y的取值;
(4)再加3molC折算成A和B,相当于6molA和6molB,由于是恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,据此可以解题。
Ⅰ.(1)若起始时,c(CO)=2 mol·L-1,c(H2O)=3 mol·L-1,平衡时CO的转化率为60%,列出三段式为: CO+H2O(g)![]() CO2+H2
CO2+H2
起始量(mol/L) 2 3 0 0
变化量(mol/L) 1.2 1.2 1.2 1.2
平衡量(mol/L) 0.8 1.8 1.2 1.2
则水蒸气的转化率为![]() ;平衡常数K的值为
;平衡常数K的值为![]() ;
;
答案为:40%;1;
(2)温度不变,平衡常数不变,设CO的转化浓度为x,据此列出三段式进行计算:
CO+H2O(g)![]() CO2+H2
CO2+H2
起始量(mol/L) 2 6 0 0
变化量(mol/L) x x x x
平衡量(mol/L) 2-x 6-x x x
则平衡常数![]() ,解得x=1.5mol/L,
,解得x=1.5mol/L,
则水蒸气的转化率为![]() ;
;
故答案为:25%;
(3)此时该反应的浓度商为![]() ,则反应正向进行;
,则反应正向进行;
故答案为:正向进行;
Ⅱ.(1)根据化学平衡三段式列式计算
A(g)+B(g)C(g)
起始量(mol) 1 1 0
变化量(mol) a a a
平衡量(mol) 1a 1a a
则A的物质的量为(1a)mol;
故答案为:1-a;
(2)在恒温恒压条件下,若开始时放入3mol A和3mol B,同等程度改变反应物的用量,A、B物质的量之比也为1:1,将建立与(1)等效的平衡状态,所以到达平衡后,依据(1)中的计算可知,生成C的物质的量为3a mol;
故答案为:3a;
(3)恒温、恒压下到达平衡后,C的物质的量为3a mol,说明与(2)所达到的平衡是完全相同的平衡状态,则满足极值转化后A、B起始量分为3mol、3mol,则有
A(g)+B(g) C(g)
起始量(mol) x 2 1
极值转化(mol) x+1 2+1=3
则x+1=3,x=2;
因为极值转化后A、B起始量分为3mol、3mol,与(1)中A、B的物质的量之比均为1:1,则为等效平衡,平衡时转化率相同,各物质的量均是A中的3倍,则平衡时A的物质的量为y=3(1-a)mol=3-3a mol;
故答案为:2;3-3a;
(4)再加3molC折算成A和B,相当于起始加入6mol A和6mol B,由于是恒压过程,此时与(1)中的平衡为等效平衡,且是成比例等效,
A(g)+B(g)C(g)
起始量1(mol) 1 1 0
平衡量1(mol) 1a 1a a
起始量2(mol) 6 6 0
平衡量2(mol) 66a 66a 6a
C的物质的量分数为![]() ;
;
故答案为:![]() 。
。

 阅读快车系列答案
阅读快车系列答案【题目】下表所列各组物质中,不能通过一步反应实现如图所示转化的是( )
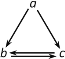
物质 选项 | a | b | c |
A. | AlCl3 | Al(OH)3 | NaAlO2 |
B. | HNO3 | NO | NO2 |
C. | Si | SiO2 | Na2SiO3 |
D. | Fe | FeCl2 | FeCl3 |
A.AB.BC.CD.D
【题目】25 ℃时,电离平衡常数:
化学式 | CH3COOH | H2CO3 | HClO | |
电离平衡常数 | 1.8×10-5 | K1 4.3×10-7 K2 5.6×10-11 | 3.0×10-8 | |
回答下列问题:
(1)下列四种离子结合质子的能力由大到小的顺序是________________;(填编号)
a.CO32- b.ClO- c.CH3COO- d.HCO3-;
(2)下列反应不能发生的是__________
A.CO32- + CH3COOH = CH3COO- + CO2 ↑ + H2O
B.ClO- + CH3COOH = CH3COO- + HClO
C.CO32- + HClO = CO2 ↑ + H2O + ClO-
D.2 ClO- + CO2 + H2O = CO32-+ 2 HClO
(3)用蒸馏水稀释0.10 mol·L-1的醋酸,则下列各式表示的数值随水量的增加而增大的是__________
A.c(CH3COOH)/c(H+) B.c(CH3COO-)/c(CH3COOH)
C.c(H+)/ KW D.c(H+)/c(OH-)
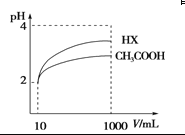
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程pH变化 如图,则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数,稀释后,HX溶液中水电离出来的c(H+)________醋酸溶液中水电离出来的c(H+)(填“大于”、“等于”或“小于”)