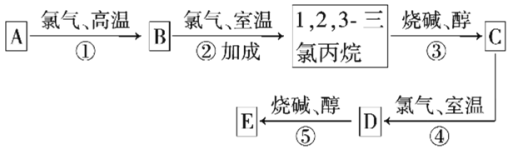
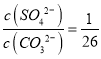题目内容
【题目】(一)已知煤气化制合成气(CO 和H2)的主要反应有:
①C(s)+H2O(g)CO(g)+H2(g)△H1=131.3kJmol﹣1
②C(s)+2H2O(g)CO2(g)+2H2(g)△H2=90kJmol﹣1
(1)有利于提高上述反应①平衡转化率的条件是_____。
A.高温高压B.高温低压C.低温高压D.低温低压
(2)研究表明,将C(s)和H2O(g)置于密闭容器中发生反应①,升高温度,增大压强,氢气的含量也显著增大,理由是_____。
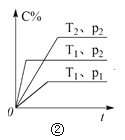
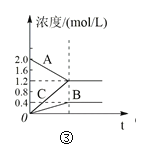
(3)由合成气制甲醇能发生反应:CO(g)+2H2(g)CH3OH(g)△H<0,在相同容积的 甲、乙、丙三个恒容密闭容器中分别投入amolCO和2amolH2,三个容器的反应温度分别为 T1、T2、T3且恒定不变,在其他条件相同的情况下,实验测得反应均进行到tmin时CO 的体积分数如图所示。
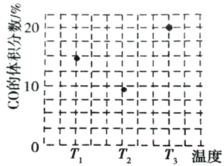
①三个容器中一定处于化学平衡状态的是_____(填“甲”“乙”或“丙”);该容器中CH3OH(g)的体积分数为_____。
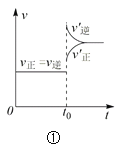
②在图中分别画出反应CO(g)+2H2(g)CH3OH(g)△H<0在无催化剂、有催化剂两 种情况下“反应过程-能量”示意图_____。

(二)运用电解法,在酸性条件下可以将CO2转化为C3H8O,写出电解生成C3H8O的电极反应式_____。
【答案】B 温度对平衡正向移动的影响大于压强对平衡逆向移动的影响 丙 40% 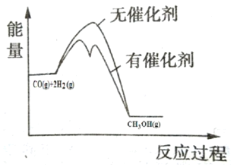 3CO2+18e﹣+18H+=C3H8O+5H2O
3CO2+18e﹣+18H+=C3H8O+5H2O
【解析】
(一)(1)反应①为吸热反应,随着反应进行,气体分子数增加,体系压强增大,升温、减压均有利于提高平衡转化率;
(2)升高温度,增大压强,氢气的含量也显著增大,说明平衡正向移动,升高温度对正向移动有利,增大压强对正向移动不利;
(3)①反应正反应为放热反应,根据图1中T1、T2、T3时CO百分含量,T2<T1<T3,结合化学平衡移动分析解答,根据平衡时CO的体积分数和化学反应方程式计算;
②催化剂降低反应的活化能,但不改变反应的焓变,据此作图;
(二)在酸性条件下可以将CO2转化为C3H8O,H+参与反应,反应为还原反应,H+转化为H2O,据此写出电极反应式。
(一)(1)反应①为吸热反应,随着反应进行,气体分子数增加,体系压强增大,升温、减压均有利于提高平衡转化率,所以控制的条件为高温低压,故答案为:B;
(2)升高温度,增大压强,氢气的含量 也显著增大,说明平衡正向移动,升高温度对正向移动有利,增大压强对正向移动不利,但平衡仍正向移动,说明温度对反应的影响大于压强对反应的影响,故答案为:温度对平衡正向移动的影响大于压强对平衡逆向移动的影响;
(3)①反应正反应为放热反应,根据图3中T1、T2、T3时CO百分含量由小到大依次为T2<T1<T3,T1中的状态转变成T2中的状态,CO百分含量减小,说明平衡正向移动,说明T1未达平衡状态,T2中的状态转变成T3中的平衡状态,CO百分含量增大,说明平衡逆向移动,说明T2可能达平衡状态,一定达到化学平衡状态的是丙,
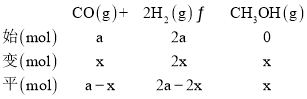
丙容器中平衡时CH3OH的体积分数为![]() ,可得x=
,可得x=![]() a,所以CH3OH(g) 的体积分数为
a,所以CH3OH(g) 的体积分数为![]() ;
;
②催化剂降低反应的活化能,但不改变反应的焓变,所以能量变化图为: ;
;
(二)在酸性条件下可以将 CO2转化为 C3H8O,H+参与反应,反应为还原反应,H+转化为H2O,所以电极反应为:3CO2+18e﹣+18H+=C3H8O+5H2O。

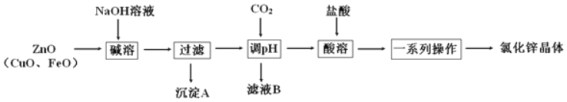
【题目】某铬盐厂净化含Cr(Ⅵ)废水并提取Cr2O3的一种工艺流程如图所示。
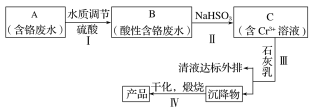
已知:Ksp[Cr(OH)3]=6.3×10-31
Ksp[Fe(OH)3]=2.6×10-39
Ksp[Fe(OH)2]=4.9×10-17
(1)步骤Ⅰ中,发生的反应为2H++2CrO42-![]() Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
Cr2O72-+H2O,B中含铬元素的离子有___(填离子符号)。
(2)当清液中Cr3+的浓度≤1.5mg·L-1时,可认为已达铬的排放标准。若测得清液的pH=5,则清液尚不符合铬的排放标准,因为此时Cr3+的浓度=__mg·L-1。
(3)步骤Ⅱ还可用其他物质代替NaHSO3作还原剂。
①若用FeSO4·7H2O作还原剂,步骤Ⅲ中参加反应的阳离子一定有__(填离子符号)。
②若用铁屑作还原剂,当铁的投放量相同时,经计算,C溶液的pH与c(Cr2O72-)的对应关系如下表所示:
pH | 3 | 4 | 5 | 6 |
c(Cr2O72-)/mol·L-1 | 7.02×10-21 | 7.02×10-7 | 1.25×10-3 | 2.21×10-34 |
有人认为pH=6时,c(Cr2O72-)变小的原因是Cr2O72-基本上都已转化为Cr3+。这种说法是否正确,为什么?___。
③用铁屑作还原剂时,为使所得产品中含铁元素杂质的含量尽可能低,需要控制的条件有___。