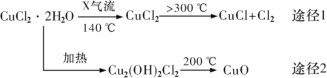题目内容
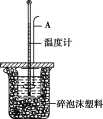
【题目】测定稀硫酸和稀氢氧化钠中和热的实验装置如下图所示。
(1)理论上强酸强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,写出表示稀硫酸和氢氧化钠稀溶液反应的中和热的热化学方程式: ____________________。
(2)仪器A的名称是 _____________;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,则测得的ΔH_____________ (填“偏大”“偏小”或“无影响”)。
(3)取50 mL NaOH溶液和30 mL硫酸溶液进行实验,实验数据如下表。
①请填写下表中的空白: ___________
实验次数 | 起始温度t1/℃ | 终止温度 t2/℃ | 温度差平均值 (t2-t1)/℃ | ||
H2SO4 | NaOH | 平均值 | |||
1 | 26.2 | 26.0 | 26.1 | 30.1 | |
2 | 27.0 | 27.4 | 27.2 | 33.3 | |
3 | 25.9 | 25.9 | 25.9 | 29.8 | |
4 | 26.4 | 26.2 | 26.3 | 30.4 | |
②近似认为0.50 mol/L NaOH溶液和0.50 mol/L硫酸溶液的密度都是1 g/cm3中和后生成溶液的比热容c=4.18 J/(g·℃)则中和热ΔH= _____________(取小数点后一位)
③上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是_____________ (填序号)。
a.实验装置保温隔热效果差
b.用量筒量取NaOH溶液的体积时仰视读数
c.分多次把NaO溶液倒入盛有硫酸的小烧杯中
d.用温度计测定NaOH溶液起始温度后直接测定H2SO4溶液的温度
【答案】![]() H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol 环形玻璃搅拌棒 偏大 4.0 -53.5 kJ/mol acd
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol 环形玻璃搅拌棒 偏大 4.0 -53.5 kJ/mol acd
【解析】
(1)中和热是指强酸强碱的稀溶液反应生成1 mol水时所放出的热量,据此写出中和热的热化学方程式;
(2)仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,酸和碱之间因发生反应而导致热量损失,据此分析中和热ΔH的误差;
(3)①分别计算4次实验的温度差,再求取温度差的平均值;
②根据公式Q=mc△T计算反应中放出的热量,再计算反应生成水的物质的量,进而计算生成1mol水所放出的热量,即为中和热;
③根据计算可知,测量值偏小,这说明反应中有热量损失,据此分析。
(1)中和热是指强酸强碱的稀溶液反应生成1 mol水时所放出的热量,已知理论上强酸、强碱的稀溶液反应生成1 mol水时放出57.3 kJ的热量,稀硫酸和氢氧化钠稀溶液分别是强酸、强碱,则中和热的热化学方程式为:![]() H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
故答案为:![]() H2SO4(aq)+NaOH(aq)===
H2SO4(aq)+NaOH(aq)===![]() Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
Na2SO4(aq)+H2O(l) ΔH=-57.3 kJ/mol或H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ/mol;
(2)仪器A的名称是环形玻璃搅拌棒;在实验过程中,如果不把温度计上的酸用水冲洗干净就直接测量NaOH溶液的温度,酸和碱之间因发生反应而导致热量损失,使测得的中和热数值将会减小,则ΔH>-57.3 kJ/mol,则ΔH 偏大;
故答案为:环形玻璃搅拌棒;偏大;
(3)①4次实验的温度差分别为:4℃,6.1℃,3.9℃,4.1℃,因此实验2中的数据是无效的,应该舍去,所以温度差的平均值为(4℃+3.9℃+4.1℃)÷3=4℃;
故答案为:4.0;
②50mL 0.50mol/L氢氧化钠与30mL0.50mol/L硫酸溶液进行中和反应,硫酸是过量的,则生成水的物质的量为0.05L×0.50mol/L=0.025mol,溶液的质量为:80ml×1g/ml=80g,温度变化的平均值为△T=4℃,则生成0.025mol水放出的热量为Q=mc△T=80g×4.18J/(g℃)×4.0℃=1337.6J,即1.3376kJ,所以实验测得的中和热![]() ;故答案为:53.5kJ/mol;
;故答案为:53.5kJ/mol;
③根据计算可知,测量值偏小,这说明反应中有热量损失,
a.装置保温、隔热效果差,测得的热量偏小,中和热的数值偏小,a项正确;
b.量取NaOH溶液的体积时仰视读数,会导致所量的氢氧化钠体积偏大,使得反应中放出的热量偏高,中和热的数值偏大,b项错误;
c.尽量一次快速将NaOH溶液倒入盛有硫酸的小烧杯中,不允许分多次把NaOH溶液倒入盛有硫酸的小烧杯中,这样会损失部分热量,测得的热量偏小,中和热的数值偏小,c项正确;
d.温度计测定NaOH溶液起始温度后直接插入稀H2SO4测温度,由于温度计上附着有氢氧化钠,会消耗硫酸,因此实验过程中放出的热量会减少,中和热的数值偏小,d项正确;
综上所述,上述实验数值结果与57.3 kJ/mol有偏差,产生偏差的原因可能是acd;
故答案为:acd。

【题目】治理SO2、CO、NOx污染是化学工作者研究的重要课题。
Ⅰ.软锰矿(MnO2)、菱锰矿(MnCO3)吸收烧结烟气中的SO2制取硫酸锰。pH值对SO2吸收率的影响如图所示。在吸收过程中,氧气溶解在矿浆中将 H2SO3氧化成硫酸。
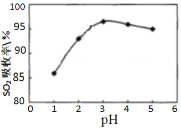
(1)SO2的吸收率在pH=_____效果最佳,MnO2所起的作用是_______,菱锰矿作为调控剂与硫酸反应, 确保pH的稳定,该反应的化学方程式为___________。
Ⅱ.沥青混凝土可作为2CO(g)+O2(g)![]() 2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
2CO2(g)反应的催化剂。图表示在相同的恒容密闭容器、相同起始浓度、相同反应时间段下,使用同质量的不同沥青混凝土(α型、β型)催化时,CO的转化率与温度的关系。
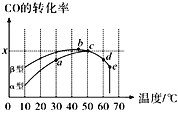
(2)CO转化反应的平衡常数K(a)____K(c)(填“>”“<”或“=”,下同),在均未达到平衡状态时,同温下β型沥青混凝土中CO转化速率___α型,e点转化率出现突变的原因可能是______。
Ⅲ.N2H4是一种具有强还原性的物质。燃烧过程中释放的能量如下:(已知a>b)
① N2H4(g)+2O2(g) == NO2(g)+1/2N2(g)+2H2O(g) ΔH1=a kJ·mol-1
② N2H4(g)+2O2(g) == 2NO(g)+2H2O(g) ΔH2=b kJ·mol-1
(3)已知反应活化能越低,反应速率越大。假设某温度下,反应Ⅰ的速率(v1)大于反应Ⅱ的速率(v2),则下列反应过程能量变化示意图正确的是______。
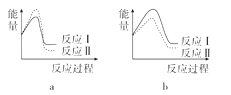
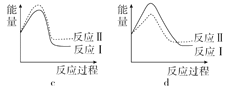
(4)试写出NO(g)分解生成N2(g)和NO2(g)的热化学方程式为_____________。
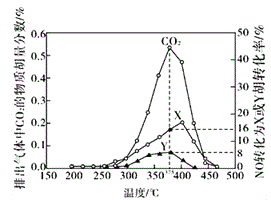
Ⅳ.某含钴催化剂可以催化消除柴油车尾气中的碳烟(C)和NOx。不同温度下,将模拟尾气(成分如下表所示)以相同的流速通过该催化剂,测得所有产物(CO2、N2、N2O)与NO的相关数据结果如下图所示。
模拟尾气 | 气体(10mol) | 碳烟 | ||
NO | O2 | He | ||
物质的量(mol) | 0.025 | 0.5 | 9.475 | n |
(5)375℃时,测得排出的气体中含0.45 molO2和0.0525mol CO2,则Y的化学式为_____。实验过程中不采用NO2的模拟NOx原因是_________。
【题目】2009年10月1日,我国成功举办国庆六十年阅兵活动。其中阅兵仪式上9辆电动车与混合动力车等新能源车辆的亮相,展示了综合国力、国防科技发展水平。同时也说明能源短缺是人类社会面临的重大问题。甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用下列两种反应合成甲醇:
反应Ⅰ: CO(g) + 2H2(g)![]() CH3OH(g) ΔH1
CH3OH(g) ΔH1
反应Ⅱ: CO2(g) + 3H2(g)![]() CH3OH(g) + H2O(g) ΔH2
CH3OH(g) + H2O(g) ΔH2
①上述反应符合“原子经济”原则的是 _____(填“Ⅰ”或“Ⅱ”)。
②下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
温度 | 250℃ | 300℃ | 350℃ |
K | 2.041 | 0.270 | 0.012 |
由表中数据判断ΔH1 0 (填“>”、“=”或“<”)。
③某温度下,将2 mol CO和6 mol H2充入2L的密闭容器中,充分反应,达到平衡后,测得c(CO)= 0.2 mol/L,则CO的转化率为 ,此时的温度为 (从上表中选择)。
(2)已知在常温常压下:
① 2CH3OH(l) + 3O2(g) = 2CO2(g) + 4H2O(g) ΔH1=-1275.6 kJ/mol
② 2CO (g)+ O2(g) = 2CO2(g) ΔH2=-566.0 kJ/mol
③ H2O(g) = H2O(l) ΔH3=-44.0 kJ/mol
写出甲醇不完全燃烧生成一氧化碳和液态水的热化学方程式:
(3)某实验小组依据甲醇燃烧的反应原理,
①设计如图所示的电池装置。该电池正极的电极反应为 。

②工作一段时间后,测得溶液的pH减小,该电池总反应的化学方程式为
。