题目内容
【题目】
Ⅰ.室温下,现有c(H+) 相同的醋酸甲和盐酸乙:
(1)相同条件下,取等体积的甲乙两溶液,各稀释100倍。稀释后的溶液,其c(H+) 大小关系为:
甲 _____________乙 (填“大于”“小于”或“等于”,下同)。
(2)各取25 mL的甲乙两溶液,分别与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲) _____________ V(乙)。
Ⅱ.已知25 ℃时有关弱酸的电离平衡常数如下:
弱酸化学式 | HSCN | CH3COOH | HCN | H2CO3 |
电离平衡常数 | 1.3×10-1 | 1.8×10-5 | 4.9×10-10 | Ka1=4.3×10-7 Ka2=5.6×10-11 |
(1)25 ℃时,将20 mL 0.1 mol·L-1 CH3COOH溶液和20 mL 0.1 mol·L-1 HSCN溶液分别与20 mL 0.1 mol·L-1 NaHCO3溶液混合,实验测得产生的气体体积(V)随时间(t)的变化如图所示:
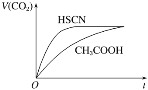
反应初始阶段两种溶液产生CO2气体的速率存在明显差异的原因是 _____________。
(2)若保持温度不变,在醋酸溶液中通入一定量氨气,下列各量会变小的是 ______________(填字母)。
a.c(CH3COO-) b.c(H+) c.Kw d.醋酸电离平衡常数
III.(1)HClO4H2SO4HCl和HNO3都是强酸,其酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数,下列说法不正确的是 _________。
酸 | HClO4 | H2SO4 | HCl | HNO3 |
Ka | 1.6×10-5 | Ka1:6.3×10-9 | 1.6×10-9 | 4.2×10-10 |
A.温度会影响这四种酸在冰醋中的电离常数
B.在冰醋酸中HClO4是这四种酸中最强的酸
C.在冰醋酸中H2SO4的电离方程式为H2SO4===2H++SO42-
D.这四种酸在冰醋酸中都没有完全电离,但仍属于强电解质
(2)亚磷酸是二元中强酸,25 ℃时亚磷酸(H3PO3)的电离常数为K1=1×10-2K2=2.6×10-7。
①试从电离平衡移动的角度解释K1为什么比K2大_______________________ 。
②写出亚磷酸的电离方程式(2步)_________________;_______________ 。
③请设计一种方案,使之能通过直观的实验现象判断醋酸的酸性强于H2S,该方案所用的试剂是 __________,反应的化学方程式为 _____________________。
【答案】大于 大于 HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快 b C 第一步电离出的H+抑制了第二步的电离 H3PO3 H2PO3- + H+ H2PO3- HPO32- + H+ 醋酸、Na2S Na2S+2CH3COOH===H2S↑+2CH3COONa
【解析】
Ⅰ.(1)根据稀释促进醋酸的电离,所以醋酸溶液中氢离子浓度减小的程度比盐酸小;
(2)c(H+)相同的醋酸甲和盐酸乙,醋酸的浓度大于盐酸,则等体积的两溶液中醋酸的物质的量大于盐酸物质的量,据此分析消耗氢氧化钠的体积;
Ⅱ.(1)由电离平衡常数可知,HSCN的酸性比CH3COOH强,则其溶液中c(H+)较大,据此分析;
(2)a. 根据电离平衡的影响因素,分析c(H+)和c(CH3COO-)的变化;
c. Kw只与温度有关,温度不变;
d. 电离平衡常数只与温度有关,温度不变;
III.(1)A. 电离常数只受温度影响;
B. 根据各种酸在醋酸中的电离平衡常数判断;
C. 在冰醋酸中硫酸为弱酸,存在电离平衡,分2步电离;
D. 这四种酸在水溶液中完全电离,属于强电解质;
(2)①第一步电离出的H+抑制了第二步的电离,所以第一步电离平衡常数与第二步电离平衡常数相差较大;
②亚磷酸是二元中强酸,存在电离平衡,其电离方程式分步写;
③根据较强酸与较弱酸的盐反应制备弱酸的原理,来证明醋酸酸性比氢硫酸酸性强。
Ⅰ.(1)c(H+) 相同的醋酸甲和盐酸乙,相同条件下,取等体积的甲乙两溶液,各稀释100倍,由于稀释促进醋酸的电离,所以醋酸溶液中氢离子浓度减小的程度比盐酸小,则稀释后的溶液,其c(H+) 大小关系为:甲大于乙;
故答案为:大于;
(2)c(H+) 相同的醋酸甲和盐酸乙,醋酸的浓度大于盐酸,则等体积的两溶液中醋酸的物质的量大于盐酸物质的量,则与等浓度的NaOH稀溶液完全反应,则消耗的NaOH溶液的体积大小关系为V(甲)大于V(乙);
故答案为:大于;
Ⅱ.(1)由电离平衡常数可知,HSCN的酸性比CH3COOH强,则其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;
故答案为:HSCN的酸性比CH3COOH强,其溶液中c(H+)较大,故其溶液与NaHCO3溶液的反应速率快;
(2)a. 醋酸溶液中存在电离平衡CH3COOH CH3COO- + H+,通入一定量氨气,生成一水合氨会中和氢离子,c(H+)减小,平衡正向移动,c(CH3COO-)增大,a项错误;
b. 由a项分析知,c(H+)减小,b项正确;
c. Kw只与温度有关,温度不变,c项错误;
d. 电离平衡常数只与温度有关,温度不变,则醋酸电离平衡常数不变,d项错误;
故答案为:b;
III.(1)A. 电离常数只受温度影响,温度对这四种酸在冰醋酸中的电离常数有影响,A项正确;
B. 在醋酸中,高氯酸的电离平衡常数最大,所以高氯酸的酸性最强,B项正确;
C. 在冰醋酸中硫酸为弱酸,存在电离平衡,所以其电离方程式为H2SO4H++HSO4、HSO4H++SO42,,C项错误;
D. 这四种酸在冰醋酸中都没有完全电离,但在水溶液中完全电离,因此仍属于强电解质,D项正确;
故答案为:C;
(2)①第一步电离出的H+抑制了第二步的电离,所以第一步电离平衡常数与第二步电离平衡常数相差较大;
故答案为:第一步电离出的H+抑制了第二步的电离;
②亚磷酸是二元中强酸,其电离方程式为H3PO3 H2PO3- + H+;H2PO3- HPO32- + H+;
故答案为:H3PO3 H2PO3- + H+;H2PO3- HPO32- + H+;
③要比较醋酸的酸性强于H2S,一般可以考虑设计实验,根据较强酸与较弱酸的盐反应制备弱酸的原理,来证明醋酸酸性比氢硫酸酸性强,只要让醋酸制得氢硫酸就可以了,所以选择相应的试剂为:醋酸和Na2S;反应方程式为:Na2S+2CH3COOH===H2S↑+2CH3COONa;
故答案为:醋酸、Na2S;Na2S+2CH3COOH===H2S↑+2CH3COONa。