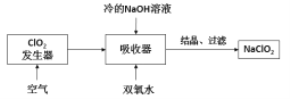
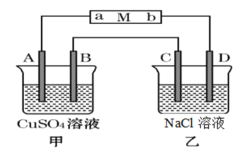
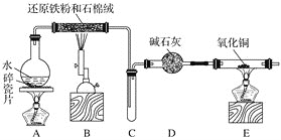
【题目】根据下列实验操作和现象所得到的结论正确的是![]()
![]()
选项 | 实验操作 | 实验现象 | 结论 |
A | 向足量含KSCN的 | 溶液变黄 | 还原性:Fe2+>Br- |
B | 向2mL浓度为 | 开始出现白色沉淀,后出现黄色沉淀 |
|
C | 取等质量的Al和Fe,分别与足量的稀硫酸反应 | Al产生的氢气多 | 金属性: |
D | 向苯酚浊液中滴加饱和 | 浊液变澄清 | 酸性:苯酚 |
A.AB.B/span>C.CD.D
【题目】煤的气化是高效、清洁的利用煤炭的重要途径之一。
①C(s)+O2(g)=CO2(g) ΔH=-393.5kJ·mol-1
②CO(g)+![]() O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
O2(g)=CO2(g)ΔH=-283.0kJ·mol-1
③H2(g)+![]() O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
O2(g)=H2O(g)ΔH=-241.8kJ·mol-1
(1)则碳与水蒸气反应生成一氧化碳和氢气的热化学方程式是_______,该反应的化学平衡常数K随温度的升高将_______(填“增大”、“减小”或“不变”)。
(2)CO可以与H2O(g)进一步发生反应CO(g)+H2O(g)![]() CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
CO2(g)+H2(g) ΔH<0。在甲、乙两个恒容密闭容器中,起始时按照下表数据进行投料,在800℃时达到平衡状态,K=1.0。
H2O | CO | CO2 | H2 | |
甲 n/mol | 0.10 | 0.30 | 0.10 | 0.50 |
乙 n/mol | 0.20 | 0.20 | 0 | 0 |
起始时,甲容器中反应向____________(填“正反应”或“逆反应”)方向进行;平衡时,乙容器中CO的转化率为___________。
【题目】氮的化合物在生产、生活中广泛存在
(1)键能是气态原子形成1mol化学键释放的最低能量。已知下列化学键的键能如表所示,写出1mol气态肼(NH2-NH2)燃烧生成氮气和水蒸气的热化学方程式_________
化学键 | N≡N | O=O | N-N | N-H | O-H |
键能/(kJ/mol) | 946 | 497 | 193 | 391 | 463 |
(2)用焦炭还原NO的反应为:2NO(g)+C(s) ![]() N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
N2(g)+CO2(g),向容积均为1L的甲、乙、丙三个恒容恒温(反应温度分别为400℃、400℃、T℃)容器中分别加入足量的焦炭和一定量的NO,测得各容器中n(NO)随反应时间t的变化情况如下表所示:
t/min | 0 | 10 | 20 | 30 | 40 |
n(NO)(甲容器)/mol | 2.00 | 1.50 | 1.10 | 0.80 | 0.80 |
n(NO)(乙容器)/mol | 1.00 | 0.80 | 0.65 | 0.53 | 0.45 |
n(NO)(丙容器)/mol | 2.00 | 1.45 | 1.00 | 1.00 | 1.00 |
该反应为_____________(填“放热”或“吸热”)反应乙容器中的反应在60min时达到平衡状态,则0-60min内用NO的浓度变化表示的平均反应速率V(NO)=_________
(3)用焦炭还原NO2的反应为:2NO2(g)+2C(s) ![]() N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
N2(g)+2CO2(g),在恒温条件下,1molNO2和足量C发生该反应,测得平衡时NO2和CO2的物质的量浓度与平衡总压的关系如图所示:
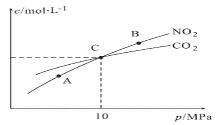
①A、B两点的浓度平衡常数关系:Kc(A)_____________Kc(B)(填“<”或“>”或“=”)。
②A、B、C三点中NO2的转化率最高的是_____________(填“A”或“B”或“C”)点。
③计算C点时该反应的压强平衡常数Kp(C)=____________(Kp是用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。