��Ŀ����
����Ŀ��2019��ŵ������ѧ�������Ϊ﮵�ط�չ����ͻ��������λ��ѧ�ҡ�ij�Ͼ�﮵��������Ҫ��LiFePO4��������̿�ڵ���ɣ�Fe��Li��P���м��ߵĻ��ռ�ֵ�������������£�

��1�����̢�����NaAlO2��Һ�����ӷ���ʽ��__��
��2�����̢���HCl/H2O2��������__��
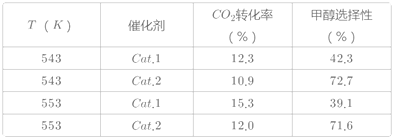
��3������ҺX����Ҫ�ɷ�Ϊ Li+��Fe3+��H2PO4-�ȡ����̢�����̼������ҺŨ��20%���¶�85 �桢��Ӧʱ��3 h�����£�̽��pH��������������Ӱ�죬��ͼ��ʾ��
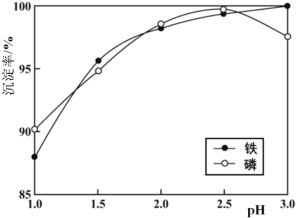
���ۺϿ��������׳����ʣ����pHΪ__��
�ڽ��ƽ���ƶ�ԭ���������̢���pH���������׳����������ԭ��__��
�۵�pH��2.5����pH���ӣ��׳����ʳ����˼�С�����ƣ�������ԭ��__��
��4��LiFePO4����ͨ��(NH4)2Fe(SO4)2��H3PO4��LiOH��Һ������������Ӧ��ȡ����������Ӧ�Ļ�ѧ����ʽΪ__��
���𰸡�2Al��2OH-��2H2O=2AlO2-��3H2�� �ܽ�LiFePO4����Fe2+����ΪFe3+��2Fe2++H2O2+2H+=2Fe3++2H2O�� 2.5 H2PO4-![]() HPO42-+H+��HPO42-
HPO42-+H+��HPO42-![]() PO43-+H+������Na2CO3��CO32-���H+ʹc(H+)��С���ٽ���������ƽ�������ƶ���c(PO43)������Fe3+����γ����������������ߣ�H2PO4-
PO43-+H+������Na2CO3��CO32-���H+ʹc(H+)��С���ٽ���������ƽ�������ƶ���c(PO43)������Fe3+����γ����������������ߣ�H2PO4-![]() HPO42-+H+��HPO42-
HPO42-+H+��HPO42-![]() PO43-+H+����ҺpH����c(H+)��С���ٽ���������ƽ�������ƶ���c(PO43-)������Fe3+����γ����������� pH��2.5ʱ�������е����������в��ֿ�ʼת������Fe(OH)3��ʹ�ò���PO43-�ͷţ������׳������½� (NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4��+H2O��(NH4)2Fe(SO4)2+H3PO4+3LiOH=(NH4)2SO4+Li2SO4+LiFePO4��+3H2O
PO43-+H+����ҺpH����c(H+)��С���ٽ���������ƽ�������ƶ���c(PO43-)������Fe3+����γ����������� pH��2.5ʱ�������е����������в��ֿ�ʼת������Fe(OH)3��ʹ�ò���PO43-�ͷţ������׳������½� (NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4��+H2O��(NH4)2Fe(SO4)2+H3PO4+3LiOH=(NH4)2SO4+Li2SO4+LiFePO4��+3H2O
��������
��LiFePO4��������̿�ڵķϾ�﮵�أ���NaOH�ܽ����ˣ���ҺΪNaAlO2��Һ������ΪLiFePO4��̿�ڣ����������ữ��H2O2�ܽ����������ˣ��õ���Ҫ�ɷ�Ϊ Li+��Fe3+��H2PO4-�ȵ���ҺX����X�м���Na2CO3��Һ����FePO42H2O���������˵���Һ��Ҫ��LiCl���ټ��뱥��Na2CO3��Һ���ٹ��˼��ɵõ�LiCO3�ֲ�Ʒ���ݴ˷������⡣
(1)���̢�Al����NaOH��Һ����NaAlO2��H2��������Ӧ�����ӷ���ʽ��2Al��2OH-��2H2O=2AlO2-��3H2����
(2)���̢��dz��������м��������ữ��H2O2�����˺�õ���Ҫ�ɷ�Ϊ Li+��Fe3+��H2PO4-�ȵ���ҺX����֪HCl/H2O2���������ܽ�LiFePO4����Fe2+����ΪFe3+��
(3)�ٷ���ͼ�����ݿ�֪����pH=2.5ʱ�ij�������ߣ����ij����ʽϸߣ�����̢�ѡ������pHΪ2.5��
����֪��ҺX�д���H2PO4-�ĵ���ƽ�⣬��H2PO4-![]() HPO42-+H+��HPO42-
HPO42-+H+��HPO42-![]() PO43-+H+�����̢��е�����Na2CO3��CO32-���H+ʹc(H+)��С���ٽ���������ƽ�������ƶ���c(PO43)������Fe3+����γ�����������������������׳����ʣ�
PO43-+H+�����̢��е�����Na2CO3��CO32-���H+ʹc(H+)��С���ٽ���������ƽ�������ƶ���c(PO43)������Fe3+����γ�����������������������׳����ʣ�
����֪FePO4(s)![]() Fe3+(aq)+ PO43-(aq)����pH��2.5����pH���ӣ���Һ��c(OH-)����Fe3+��ʼת������Fe(OH)3���ٽ���ƽ�������ƶ���ʹ�ò���PO43-�ͷţ������׳������½���
Fe3+(aq)+ PO43-(aq)����pH��2.5����pH���ӣ���Һ��c(OH-)����Fe3+��ʼת������Fe(OH)3���ٽ���ƽ�������ƶ���ʹ�ò���PO43-�ͷţ������׳������½���
(4)(NH4)2Fe(SO4)2��H3PO4��LiOH��Һ�������LiFePO4��ͬʱ�õ�(NH4)2SO4��Li2SO4�����ԭ���غ㣬������Ӧ�Ļ�ѧ����ʽΪ (NH4)2Fe(SO4)2+H3PO4+LiOH=2NH4HSO4+LiFePO4��+H2O��

 һ����ʦȨ����ҵ��ϵ�д�
һ����ʦȨ����ҵ��ϵ�д�