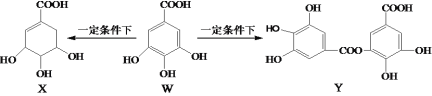题目内容
【题目】如图当线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,b端显红色,且知甲中电极材料是锌、银,乙中电极材料是铂。回答:
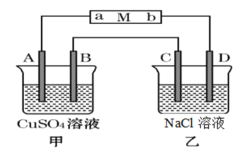
(1)甲、乙分别是什么装置_____________、______________。
(2)A电极材料为_____________,B电极上的电极反应为:______________。
(3)请解释a处变蓝的原因:________________
(4)已知乙中溶液体积为100 mL,当B上析出0.32 g红色物质时,此时乙中溶液的pH=__________(不考虑溶液体积的变化,温度为室温)。
【答案】原电池 电解池或电解槽 Zn Cu2++2e-=Cu a端为电解池的阴极,水电离出的H+放电,使水电离平衡右移,溶液中c(OH-)>c(H+),溶液呈碱性,使石蕊试液变蓝 13
【解析】
线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,则a端为碱性,氢离子放电,a极为阴极;b端显红色,则b端为酸性,氢氧根离子放电,b极是阳极。根据电解原理可知:和电源的正极相连的是阳极,和电源的负极相连的是阴极,根据原电池、电解池的构成条件以及工作原理知识来回答。
线路接通时,发现M(用石蕊试液浸润过的滤纸)a端显蓝色,则a端为碱性,氢离子放电,a极为阴极;b端显红色,则b端为酸性,氢氧根离子放电,b极是阳极。
(1)甲中电极材料是锌、银,有活动性不同的电极,与电解质溶液形成了闭合回路,Zn能够与CuSO4溶液自发进行氧化还原反应,因此甲池为原电池,Zn作负极,Ag作正极;乙池中两个电极都是铂电极,与原电池相连形成闭合回路,则乙池为电解池;
(2)根据上述分析可知a为阴极,与电源负极连接;b为阳极,与电源的正极连接。由于甲池为原电池,金属活动性Zn>Ag,所以Zn为负极,Ag为正极,所以甲池中与a连接的电极A为Zn电极,与b连接的电极B为Ag电极,正极Ag上溶液中的Cu2+得到电子,发生还原反应,电极反应式为:Cu2++2e-=Cu;
(3)a处与电源负极连接,为电解池的阴极,石蕊试液中的水电离产生的H+不断放电,破坏了负极的水的电离平衡,使水的电离平衡正向移动,最终达到平衡时,附近溶液中c(OH-)>c(H+),溶液显碱性,因此使石蕊试液变蓝色;
(4)B电极发生反应:Cu2++2e-=Cu,当B上析出0.32 g红色物质时,产生Cu的物质的量是n(Cu)=![]() =0.005 mol,则转移电子的物质的量为n(e-)=2n(Cu)=0.01 mol,乙池总反应方程式为:2NaCl+2H2O
=0.005 mol,则转移电子的物质的量为n(e-)=2n(Cu)=0.01 mol,乙池总反应方程式为:2NaCl+2H2O![]() Cl2↑+H2↑+2NaOH,根据方程式可知:每产生2 mol NaOH时,转移2 mol电子。由于在同一闭合回路中电子转移数目相等,所以转移0.01 mol电子时,反应产生NaOH的物质的量是0.01 mol,乙池溶液体积是100 mL,则反应产生NaOH溶液的浓度为c(NaOH)=
Cl2↑+H2↑+2NaOH,根据方程式可知:每产生2 mol NaOH时,转移2 mol电子。由于在同一闭合回路中电子转移数目相等,所以转移0.01 mol电子时,反应产生NaOH的物质的量是0.01 mol,乙池溶液体积是100 mL,则反应产生NaOH溶液的浓度为c(NaOH)=![]() =0.1 mol/L,则溶液中c(H+)=
=0.1 mol/L,则溶液中c(H+)=![]() mol/L=10-13 mol/L,所以该溶液的pH=13。
mol/L=10-13 mol/L,所以该溶液的pH=13。

 新思维假期作业寒假吉林大学出版社系列答案
新思维假期作业寒假吉林大学出版社系列答案