题目内容
【题目】某研究性学习小组利用下列有关装置对SO2的性质及空气中SO2的含量进行探究(装置的气密性已检查):
(1)装置A中反应的化学方程式是________.
(2)滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹.此操作的目的是 ______。
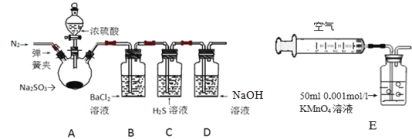
(3)实验过程装置B中没有明显变化.实验结束取下装置B,从中分别取少量溶液于两支洁净试管中,向第1支试管中滴加适量氨水出现白色沉淀___________(填化学式);向第2支试管中滴加适量新制氯水,仍然出现白色沉淀,该反应的离子方程式是______。
(4)装置C中的溶液中出现淡黄色浑浊,该实验证明SO2具有___ 性.
(5)装置D的作用是______。
(6)另一小组利用装置E进行实验:SO2性质实验之后,用注射器对实验室内空气进行取样.并向装置E中共注入V mL(已折算为标况下体积)的空气,当溶液刚好褪色时,停止实验.请计算该空气中SO2的体积分数(用含V的代数式表示)______。
【答案】Na2SO3+H2SO4(浓)==SO2 + Na2SO4 +H2O排出装置中的空气避免干扰Ba2SO3Ba2++SO2 + Cl2 +2H2O=== BaSO4+ 4H+ +2Cl-氧化性尾气吸收防止污染2.8/V
【解析】
(1)装置A中亚硫酸钠和浓硫酸反应生成硫酸钠、二氧化硫气体和水,据此写出反应的化学方程式;(2)装置中氧气影响二氧化硫的性质实验,故需要用氮气除去系统中的空气;(3)二氧化硫易溶于水,但是二氧化硫不与氯化钡溶液反应,当向溶液中通入氨气后生成亚硫酸铵,亚硫酸铵溶液与氯化钡反应生成亚硫酸钡;氯气具有强氧化性,氯气将二氧化硫氧化成硫酸,硫酸与氯化钡反应生成氯化钡沉淀,据此写出反应的离子方程式;(4)二氧化硫与硫化氢反应生成淡黄色的S单质,二氧化硫表现了氧化性;(5)二氧化硫有毒,多余的气体需要用氢氧化钠溶液吸收;(6)向实验1的溶液中加入足量氯化钡溶液,根据溶液颜色变化判断。
(1)装置A中亚硫酸钠和浓硫酸反应生成二氧化硫气体,反应的化学方程式为:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,因此答案是:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O。
(2)装置中的氧气影响二氧化硫的性质实验,所以为了排除装置中空气,应该滴加浓硫酸之前,打开弹簧夹,通入一段时间N2,再关闭弹簧夹,因此答案是:排除装置中氧气对实验的干扰。
(3)向第1支试管中滴加适量氨水,氨水与二氧化硫反应生成亚硫酸铵,亚硫酸铵与氯化钡反应生成亚硫酸钡白色沉淀;氯气将二氧化硫氧化成硫酸,硫酸与钡离子反应生成硫酸钡沉淀,反应的离子方程式为:Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-。因此,答案是:BaSO3;Ba2++SO2+Cl2+2H2O=BaSO4↓+4H++2Cl-。
(4)C中发生反应为:2H2S+SO2=3S↓+2H2O,反应中二氧化硫得电子化合价降低而作氧化剂,表现了氧化性,因此,本题正确答案是:氧化。
(5)二氧化硫气体是一种有毒气的酸性氧化物,多余的气体不能直接排放,需要用氢氧化钠溶液吸收,因此答案是:吸收SO2尾气,防止污染空气。
(6)二氧化硫与高锰酸钾发生氧化还原反应,二氧化硫被氧化为硫酸根离子,高锰酸根离子被还原为锰离子,则Mn元素得到电子的物质的量是0.05L×0.001mol/L×5=2.5×10-4mol,根据得失电子守恒,设空气中二氧化硫的物质的量是x,则(6-4)x=2.5×10 -4mol,x=1.25×10 -4mol,标准状况下的条件是1.25×10 -4mol×22.4L/mol=2.8×10-3L=2.8mL,所以该空气中SO 2的体积分数为2.8/V。 答案:2.8/V。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】探究草酸(H2C2O4)性质,进行如下实验。(已知:室温下,0.1 mol·L1 H2C2O4的pH=1.3)
实验 | 装置 | 试剂a | 现象 |
① |
| Ca(OH)2溶液(含酚酞) | 溶液褪色,产生白色沉淀 |
② | 少量NaHCO3溶液 | 产生气泡 | |
③ | 酸性KMnO4溶液 | 紫色溶液褪色 | |
④ | C2H5OH和浓硫酸 | 加热后产生有香味物质 |
由上述实验所得草酸性质所对应的方程式不正确的是
A. H2C2O4有酸性,Ca(OH)2+ H2C2O4![]() CaC2O4↓+2H2O
CaC2O4↓+2H2O
B. 酸性:H2C2O4> H2CO3,NaHCO3+ H2C2O4![]() NaHC2O4+CO2↑+H2O
NaHC2O4+CO2↑+H2O
C. H2C2O4具有还原性,2![]() +5
+5![]() +16H+
+16H+![]() 2Mn2++10CO2↑+ 8H2O
2Mn2++10CO2↑+ 8H2O
D. H2C2O4可发生酯化反应,HOOCCOOH+2C2H5OH![]() C2H5OOCCOOC2H5+2H2O
C2H5OOCCOOC2H5+2H2O