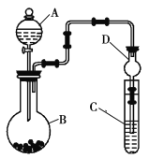
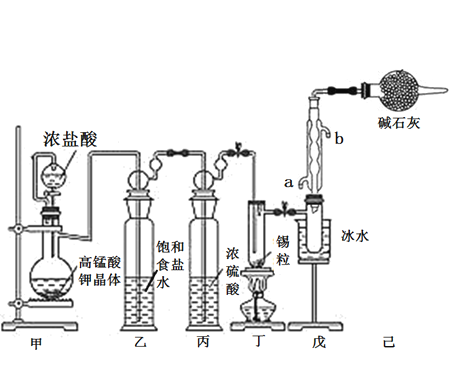
【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液
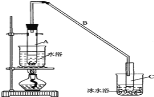
【题目】某化学小组采用类似制乙酸乙酯的装置(如图),以环己醇制备环己烯:
密度(g/cm3) | 熔点(℃) | 沸点(℃) | 溶解性 | |
环己醇 | 0.96 | 25 | 161 | 能溶于水 |
环己烯 | 0.81 | -103 | 83 | 难溶于水 |
已知: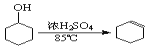 +H2O
+H2O
(1)制备粗品:将12.5mL环己醇加入试管A中,再加入1mL浓硫酸,摇匀后放入碎瓷片,缓慢加热至反应完全,在试管C内得到环己烯粗品。
①A中碎瓷片的作用是__,导管B除了导气外还具有的作用是__。
②试管C置于冰水浴中的目的是__。
(2)制备精品
①环己烯粗品中含有环己醇和少量酸性杂质等。加入饱和食盐水,振荡、静置、分层,环己烯在__层(填“上”或“下”),分液后用__(填入编号)洗涤。
A.KMnO4溶液 B.稀H2SO4 C.Na2CO3溶液
②如再将环己烯进行蒸馏,冷却水应从__口进入(填“上”或“下”)。
【题目】硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
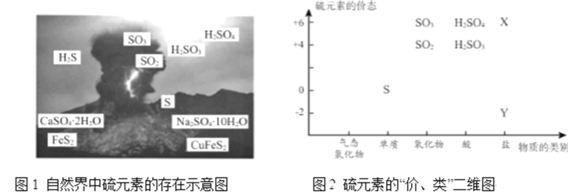
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
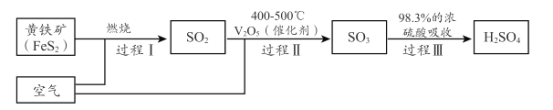
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2 和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2 和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
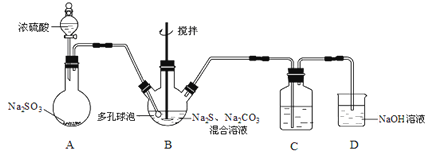
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
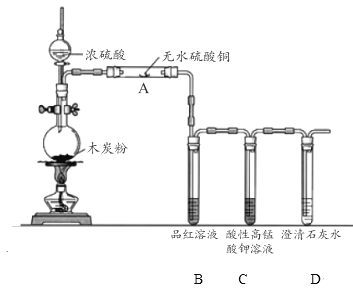
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。