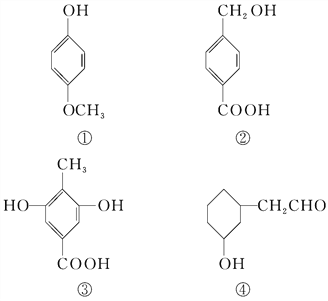
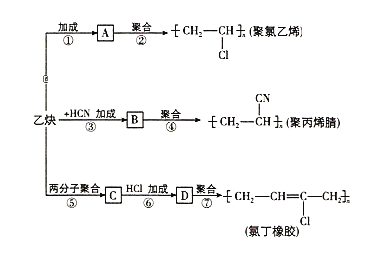
题目内容
【题目】硫元素是动植物生长不可缺少的元素,广泛存在于自然界中。
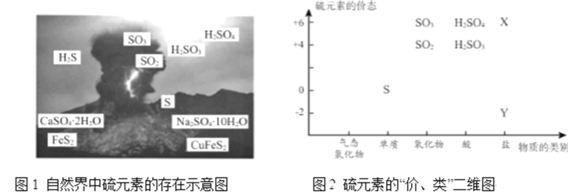
从图1中选择符合图2要求的 X 、Y 代表的物质:X ______、Y ________。
(2)硫酸是重要的化工原料,小组同学对硫酸的工业制备和性质进行探究。查阅资料,工业制硫酸的过程如下:
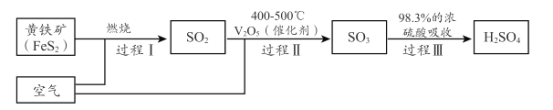
①上述工业制硫酸过程中,没有发生氧化还原反应的过程是______________ 。(填“I ”“ II”或“III” )
②黄铁矿( FeS2 ) 中S为- 1价,完成过程 I 的化学反应方程式:______FeS2十______=_____Fe2O3+ _____SO2↑
③过程 II 中,小组同学在 500°C 和 10l kPa 条件下,将一定量的 SO2 和 O2充入含有催化剂的密闭容器中发生反应,随着反应的进行,用气体传感器测量各组分的浓度见下表
反应时间/ s | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 100 |
c ( SO2 ) / ( mol L -1) | 10 | 7 | 5 | 3.5 | 2 | 1 | 1 | 1 | 1 |
c ( O2 ) / ( mol L -1) | 5 | 3.5 | a | 1.75 | 1 | 0.5 | b | 0.5 | 0.5 |
c ( SO3 ) / ( mol L -1) | 0 | 3 | 5 | 6.5 | 8 | 9 | 9 | 9 | 9 |
数据分析,表中 a 、b 代表的数值分别是:a =________、b = _______;小 组同学判断 SO2 和 O2的 反应 50 秒后处于平衡状态,他们的判断依据是___________。
(3)浓硫酸与木炭在加热条件下可发生化学反应 ,为了检验反应产物,某同学设计了如下图所示的实验(部分夹持装置省略)。回答相关问题
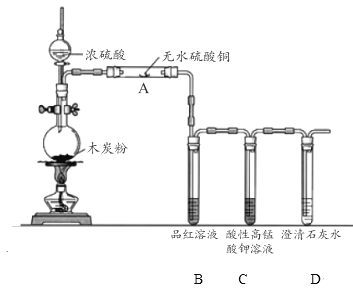
①浓硫酸与木炭反应的化学方程式是 ________________。
②装置 A 中的实验现象是____________;证明的产物是___________ 。
③装置 C 的作用是_______________ 。
④该同学认为,如果去掉装置 B 也能实现产物的验证,该同学依据的实验现象及推理过程是__________________。
【答案】CaSO42H2O和Na2SO410H2O CuFeS2 III 4 11O2 2 8 2.5 0.5 自50s开始SO2、SO3的浓度保持不变 ![]() 固体由白色变为蓝色 H2O 除去CO2中的SO2,并检验是否除尽 酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽。
固体由白色变为蓝色 H2O 除去CO2中的SO2,并检验是否除尽 酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽。
【解析】
(1)从图2可知X、Y分别代表+6价的盐和-2价的盐,图1中只有CuFeS2和CaSO42H2O、Na2SO410H2O,故答案为:CaSO42H2O和Na2SO410H2O;CuFeS2;
(2)①氧化还原反应的特征是元素的化合价发生变化,过程I 由FeS2中- 1价的S转化为SO2中+4价的S,故是氧化还原反应,过程II是由SO2中+4价的S转化为SO3中+6价的S,故是氧化还原反应,过程III由SO3转化为H2SO4没有化合价的改变,故不是氧化还原反应,答案为:III;
②根据反应前后元素种类不变发现,反应物在缺少O元素,故反应物中由O2,再黄铁矿( FeS2 ) 中S为- 1价转化为SO2中+4价,Fe为+2价转化为Fe2O3中+3价,故可1molFeS2在反应中共失去11mole-,而1molO2由0价转化为-2价,得到4mole-,根据得失电子守恒,最小公倍数为44,故FeS2前面的系数为4,氧气的系数为11,再根据硫原子守恒可知SO2的系数为8,根据铁原子守恒可知Fe2O3的系数为2,故答案为:4 ;11O2 ;2;8;
③根据过程II 中发生的反应进行计算: ,可知a=5-2.5=2.5,从表中可知,自50s以后SO2、SO3的浓度均不再改变,说明从50s开始反应达到化学平衡,故b=0.5,化学平衡的重要标志是正逆反应速率相等,体系各组分的浓度保持不变,故答案为:2.5; 0.5 ;自50s开始SO2、SO3的浓度保持不变;
,可知a=5-2.5=2.5,从表中可知,自50s以后SO2、SO3的浓度均不再改变,说明从50s开始反应达到化学平衡,故b=0.5,化学平衡的重要标志是正逆反应速率相等,体系各组分的浓度保持不变,故答案为:2.5; 0.5 ;自50s开始SO2、SO3的浓度保持不变;
(3) ①浓硫酸与木炭在加热条件下生成SO2、CO2和H2O,故浓硫酸与木炭反应的化学方程式是![]() ,故答案为:
,故答案为:![]() ;
;
②装置 A 中装有白色的无水硫酸铜遇水会变为蓝色的硫酸铜晶体(CuSO45H2O),故装置 A 中的实验现象是固体由白色变为蓝色,证明的产物是H2O;故答案为:固体由白色变为蓝色;H2O;
③装置B是检验SO2的,现象为品红溶液红色褪去,由于CO2、SO2均能使澄清石灰水变浑浊,故需先出去SO2再检验CO2,故装置 C 的作用是除去CO2中的SO2,并根据褪色情况检验SO2是否除尽,故答案为:除去CO2中的SO2,并检验是否除尽;
④CO2不能使酸性高锰酸钾溶液褪色,而SO2可以,SO2使酸性高锰酸钾溶液褪色的过程也使吸收SO2的过程,故酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,故答案为:酸性高锰酸钾溶液既能检验SO2又能除去CO2中的SO2,酸性高锰酸钾溶液颜色变浅说明产物中有SO2,而溶液未完全褪色时,说明SO2已经被除尽。

【题目】锡是大名鼎鼎的“五金”-金、银、铜、铁、锡之一。SnCl4可用作媒染剂,可利用如下图所示装置可以制备SnCl4(部分夹持装置己略去);
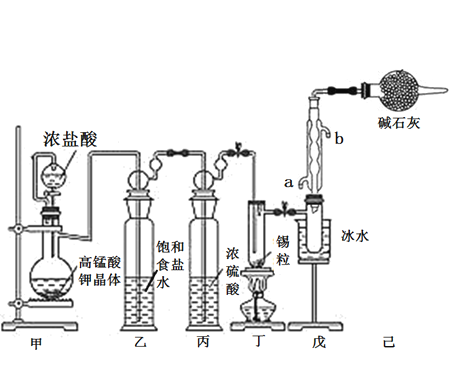
有关信息如下表:
化学式 | SnCl2 | SnCl4 |
熔点/℃ | 246 | -33 |
沸点/℃ | 652 | 144 |
其他性质 | 无色晶体,易氧化 | 无色液体,易水解 |
回答下列问题:
(1)乙中饱和食盐水的作用为___________;戊装置中冷凝管的进水口为________(填“a”或“b”)。
(2)甲装置发生反应的离子方程式为________________。
(3)将装置如图连接好,检查气密性,慢慢滴入浓盐酸,待观察到丁装置内充满黄绿色气体后,开始加热丁装置,锡熔化后适当增大氯气流量,继续加热丁装置,此时继续加热丁装置的目的是:
①促进氯气与锡反应;
②__________________。
(4)己装置的作用是_______________。
(5)某同学认为丁装置中的反应可能产生SnCl2杂质,以下试剂中可用于检测是否产生SnCl2的有__________(填标号)。
A.FeCl3溶液(滴有几滴KSCN溶液) B.溴水 C.AgNO3溶液
【题目】下列有关实验的图示及分析均正确的是( )
选项 | 实验目的 | 实验图示 | 实验分析 |
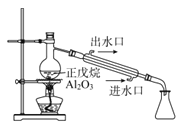
A | 催化裂解正戊烷并收集产物 |
| 正戊烷裂解为分子较小的烷烃和烯烃 |
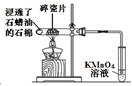
B | 石蜡油的分解并检验产物 |
| 石蜡油分解的 产物含有不饱和烃 |
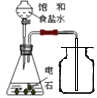
C | 制取并收集乙炔 |
| 用饱和食盐水代替纯水,可达到降低反应速率的目的 |
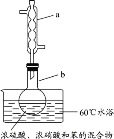
D | 实验室制硝基苯 |
| 反应完全后,可用仪器a、b蒸馏提纯产品 |
A.AB.BC.CD.D