题目内容
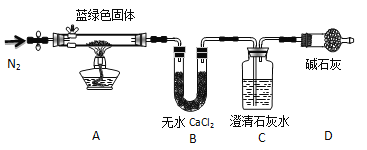
【题目】硫代硫酸钠晶体(Na2S2O3·5H2O)俗名“大苏打”,又称“海波”。己知它易溶于水,难溶于乙醇,加热易分解,具有较强的还原性,广泛地应用于照相等工业中。某实验室模拟工业硫化碱法制取硫代硫酸钠,其反应装置及所需试剂如图:
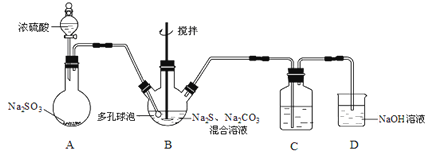
(1)装置A中发生反应的化学方程式是_____________。
(2)装置B中通入SO2反应生成Na2S2O3和CO2,其离子方程式为_____________________,生成的硫代硫酸钠粗品可用_______________洗涤。
(3)装置C的作用是检验装置B中SO2的吸收效率,C中试剂是___________,表明SO2吸收效率低的实验现象是C中溶液颜色很快褪色。为了使SO2尽可能吸收完全,在不改变B中溶液浓度、体积的条件下,除了及时搅拌反应物外,还可采取的合理措施是__________(写出-条)。
(4)酸性条件下,S2O32-自身发生氧化还原反应生成SO2。试写出Na2S2O3与盐酸反应的离子方程式:_______________________。
(5)粗品中Na2S2O3·5H2O的质量分数的测定
称取6g粗品配制250mL的溶液待用。另取25mL 0.01 mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,耗Na2S2O3溶液25mL。粗品中Na2S2O3·5H2O的质量分数为________________。(己知Cr2O72-+6I-+14H+=2Cr3++3I2+7H2O、I2+2S2O32-=2I-+S4O62-)
【答案】Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O 4SO2+2S2-+CO32-=CO2↑+3S2O32 乙醇 品红、溴水或KMnO4溶液 控制SO2的流速(或增大SO2的接触面积或适当升高温度) S2O32-+2H+=S↓+SO2↑+H2O 62%
【解析】
装置A为二氧化硫的制取:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,B装置为Na2S2O3的生成装置:2Na2S+Na2CO3+4SO2=3Na2S2O3+CO2,二氧化硫能和品红作用,二氧化硫能被高锰酸钾氧化,能与溴单质,上述溶液均褪色,所以装置C中盛放品红、溴水或KMnO4溶液,其作用是检验装置B中SO2的吸收效率,二氧化硫有毒,不能直接排放到空气中,装置D作用为尾气吸收装置,吸收未反应的二氧化硫;
(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应生成硫酸钠和水和二氧化硫;
(2)根据题目信息SO2、Na2S和Na2CO3反应生成Na2S2O3,结合质量守恒确定产物并配平,硫代硫酸钠晶体易溶于水,难溶于乙醇,生成的硫代硫酸钠粗品可用乙醇洗涤;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液;要加快反应速率,可增大接触面积,增大浓度、升高温度等;
(4) 酸性条件下,S2O32-自身发生氧化还原反应生成SO2 、S和水;
(5) 依据反应的定量关系 2S2O32-~I2,计算碘单质消耗的硫代硫酸钠,计算得到样品的纯度。
(1)装置A为二氧化硫的制取,亚硫酸钠和浓硫酸发生复分解反应:Na2SO3+H2SO4(浓)=Na2SO4+SO2↑+H2O,生成二氧化硫;
(2)三颈烧瓶B中制取Na2S2O3反应的总化学反应方程式为:4SO2+2Na2S+Na2CO3=CO2↑+3Na2S2O3,离子反应为:4SO2+2S2-+CO32-=CO2↑+3S2O32-,硫代硫酸钠晶体易溶于水,难溶于乙醇,乙醇易挥发,生成的硫代硫酸钠粗品可用乙醇洗涤;
(3)装置B的作用是检验装置A中SO2的吸收效率,说明B中物质能与二氧化硫反应,且有明显的现象,一般可为品红、溴水或KMnO4溶液等,如A中SO2吸收效率低,则B中进入较多的二氧化硫,导致B中溶液颜色很快褪色。要加快反应速率,可增大气体与液体的接触面积,增大浓度,减慢二氧化硫的流速、升高温度等;
(4) 硫代硫酸根离子和氢离子反应生成硫、二氧化硫和水,离子反应方程式为:S2O32-+2H+═S↓+SO2↑+H2O;
(5) Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O,I2+2S2O32-═2I-+S4O62-,得定量关系 Cr2O72-~6S2O32-~3I2,另取25mL0.01mol/L K2Cr2O7溶液于锥形瓶中,然后加入过量的KI溶液并酸化和几滴淀粉溶液,立即用配制的Na2S2O3溶液滴定至终点,消耗Na2S2O3溶液25mL,n(Cr2O72-)=0.025L×0.0lmolL-1=0.00025mol,n(S2O32-)=0.00025mol×6=0.0015mol,粗品中Na2S2O35H2O的质量分数为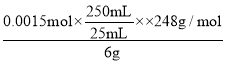 ×100%=62%。
×100%=62%。