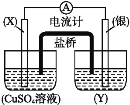
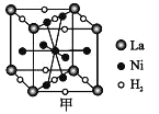
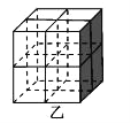
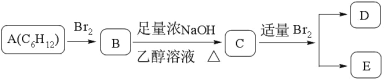
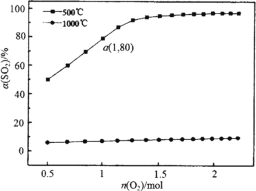
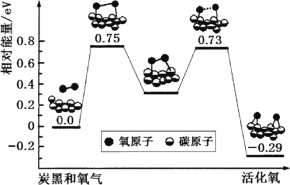
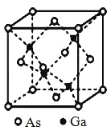
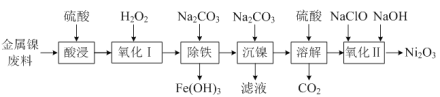
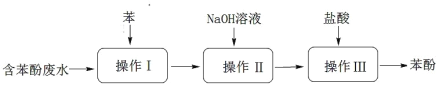
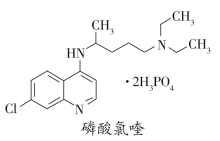
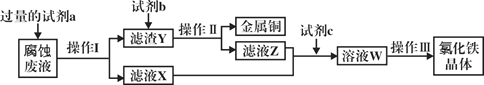
0 199635 199643 199649 199653 199659 199661 199665 199671 199673 199679 199685 199689 199691 199695 199701 199703 199709 199713 199715 199719 199721 199725 199727 199729 199730 199731 199733 199734 199735 199737 199739 199743 199745 199749 199751 199755 199761 199763 199769 199773 199775 199779 199785 199791 199793 199799 199803 199805 199811 199815 199821 199829 203614