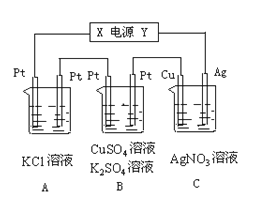
题目内容
【题目】工业上以金属镍废料(除NiO外,还含有少量的FeO、Fe2O3) 为原料生产Ni2O3的流程如下:
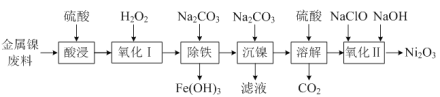
(1) “酸浸”时,Fe2O3发生反应的化学方程式为_____。
(2) “氧化Ⅰ”时,加入双氧水的目的是_____。
(3) “沉镍”时,检验Ni2+沉淀完全的操作是_____。
(4) “氧化Ⅱ”时,发生反应的离子方程式为_____。
【答案】Fe2O3+3H2SO4=Fe2(SO4)3+3H2O 将Fe2+氧化为Fe3+ 静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,说明已沉淀完全,反之则没有沉淀完全 2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O
【解析】
金属镍废料(除NiO外,还含有少量的FeO、Fe2O3),加硫酸酸浸后的酸性溶液中含有金属离子Ni2+、Fe2+、Fe3+,加入过氧化氢氧化亚铁离子为铁离子,加入碳酸钠溶液调节溶液的pH,使铁离子全部沉淀,过滤后的滤液中再加入碳酸钠沉淀镍离子得NiCO3,将NiCO3再溶于硫酸,得硫酸镍溶液,向其中加入次氯酸钠和氢氧化钠溶液可得Ni2O3。
(1) “酸浸”时,Fe2O3与硫酸反应生成硫酸铁和水,化学方程式为Fe2O3+3H2SO4=Fe2(SO4)3+3H2O。
(2)综上分析 “氧化Ⅰ”时,加入双氧水的目的是将Fe2+氧化为Fe3+。
(3) “沉镍”时,检验Ni2+沉淀完全的操作是静置,向上层清液中继续滴加Na2CO3溶液,若不再产生沉淀,说明已沉淀完全,反之则没有沉淀完全。
(4) “氧化Ⅱ”时,加入次氯酸钠和氢氧化钠与硫酸镍发生氧化还原反应,镍化合价由+2价变为+3价生成三氧化二镍,氯元素化合价由+1价降为-1价,反应的离子方程式为2Ni2++ClO-+4OH-=Ni2O3↓+Cl-+2H2O。

 开心快乐假期作业暑假作业西安出版社系列答案
开心快乐假期作业暑假作业西安出版社系列答案 名题训练系列答案
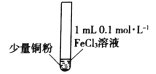
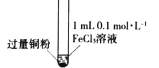
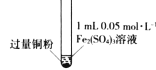
名题训练系列答案【题目】某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号 | I | II | III |
实验步骤 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
充分振荡,加入2mL蒸馏水 |
实验现象 | 铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象 | 铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀 | 铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀 |
下列说法不正确的是
A. 实验I、II、III中均涉及Fe3+被还原
B. 对比实验I、II说明白色沉淀的产生与铜粉的量有关
C. 实验II、III中加入蒸馏水后c(Cu2+)相同
D. 向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
【题目】在一定体积的密闭容器中进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
CO(g)+H2O(g),其化学平衡常数(K)和温度(t)的关系如下表所示:
t/℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=___;
(2)该反应为___(填“吸热”或“放热”)反应;
(3)能判断该反应达到化学平衡状态的依据是___;
A.容器中压强不变
B.混合气体中c(CO)不变
C.V正(H2)=V逆(H2O)
D.c(CO2)=c(CO)
(4)在800℃时,发生上述反应,某一时刻测得容器内各物质的浓度分别为c(CO2)为2mol·L-1,c(H2)为1.5mol·L-1,c(CO)为1mol·L-1,c(H2O)为3mol·L-1,则下一时刻,反应向___(填“正向”或“逆向”)进行。