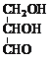题目内容
【题目】依据氧化还原反应:2Ag++Cu=Cu2++2Ag,设计的原电池如图所示。
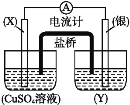
请回答下列问题:
(1)电极X的材料是___;电极X是原电池的___极;
(2)银电极发生的电极反应为___;
(3)今有2H2+O2![]() 2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
2H2O反应构成燃料电池,则正极通的应是___;负极的电极反应式为___。
【答案】Cu 负 Ag++e-=Ag O2 H2+2OH--2e-=2H2O
【解析】
根据总反应:2Ag++Cu=Cu2++2Ag,Cu元素的化合价由0价升至+2价,Cu作负极,发生氧化反应;Ag元素的化合价由+1价降至0价,Ag作正极,Ag+发生还原反应,据此分析解答。
(1)根据上述分析可知,Cu发生氧化反应,根据原电池中负极发生失电子的氧化反应,Cu应为原电池的负极,故答案为:Cu;负;
(2)银电极为电池的正极,正极上反应为Ag+得电子被还原成Ag,发生的电极反应为Ag++e-=Ag,故答案为:Ag++e-=Ag;
(3)由反应2H2+O2![]() 2H2O可知,电解质溶液为KOH,H化合价升高,H2在负极失去电子,电极反应式为H2+2OH--2e-=2H2O,O化合价降低,O2在正极得到电子,电极反应式为O2+4e-+2H2O===4OH-,故答案为:O2;H2+2OH--2e-=2H2O。
2H2O可知,电解质溶液为KOH,H化合价升高,H2在负极失去电子,电极反应式为H2+2OH--2e-=2H2O,O化合价降低,O2在正极得到电子,电极反应式为O2+4e-+2H2O===4OH-,故答案为:O2;H2+2OH--2e-=2H2O。

【题目】某学习小组探究稀HNO3、浓HNO3与铜的反应。
装置(尾气处理装置略) | 现象 |
| Ⅰ中开始无明显现象,渐有小气泡生成,越来越剧烈,液面上方出现浅红棕色气体,溶液呈蓝色。 |
Ⅱ中反应剧烈,迅速生成大量红棕色气体,溶液呈绿色。 |
(1)试管Ⅰ中Cu与稀HNO3反应的化学方程式是________。
(2)Ⅱ中反应的速率比Ⅰ中的快,原因是________。
(3)针对Ⅱ中溶液呈绿色的原因,提出假设:
假设1:Cu2+的浓度较大所致;

假设2:溶解了生成的NO2。
探究如下:取Ⅱ中绿色溶液,分为两等份。
①取一份于如图所示装置中,_______(填“操作”和“现象”),证实Ⅱ中溶解了NO2。
②向另一份溶液加入_____(填化学试剂),溶液变为蓝色。证实假设1不成立,假设2成立。
(4)对于稀HNO3与铜生成NO、浓HNO3与铜生成NO2的原因,提出两种解释:
解释1.HNO3浓度越稀,溶液中NO3-的数目越少,被还原时,每个NO3-从还原剂处获得较多电子的机会_____(填“增多”或“减少”),因此被还原为更低价态。
解释2.推测下列平衡导致了产物的不同,并通过如下实验证实了推测的合理性。
3NO2+H2O=2HNO3+NO

①B中盛放的试剂是________。
②C中盛放Cu(NO3)2和_________。
③该小组证实推测的合理性所依据的实验现象是________。
【题目】某小组同学在实验室研究Al与CuCl2溶液的反应.
实验操作 | 实验现象 |
|
|
(1)现象![]() 中的红色物质是 ______ .
中的红色物质是 ______ .
(2)经检验现象![]() 中的无色气体为氢气.
中的无色气体为氢气.
①甲认为Al与H+反应产生了氢气,用离子方程式表示溶液中存在大量H+的原因 ______.
②氢气从红色物质表面逸出的原因是 ______ .
(3)探究白色沉淀的化学成分.
查阅资料:Cu+可与浓氨水反应生成Cu(NH3)2+(无色),该无色物质在空气中易被氧化变为蓝色.
乙认为白色沉淀可能是CuCl,并通过实验证明其猜测正确,实验步骤如下:
a.取白色沉淀,充分洗涤;
b.向其中加入浓氨水,沉淀溶解得到无色溶液,将无色溶液分为两份;
c.取其中一份无色溶液![]()
d.将另一份无色溶液放置于空气中,一段时间后,溶液变为蓝色.
①步骤c的实验方案是 ______.
②用化学平衡移动原理解释CuCl溶于浓氨水的原因 ______.
(4)探究CuCl产生的原因.
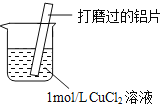
①丙猜测可能是Cu与CuCl2溶液反应生成了CuCl,因为Cu具有 ______性.
②取Cu粉与1mol/LCuCl2溶液混合,无白色沉淀产生,丙再次分析Al与CuCl2溶液反应的实验现象,改进实验方案,证明了Cu与CuCl2溶液反应生成了CuCl,改进之处是 ______ .