��Ŀ����
����Ŀ�������仯�������ճ�����������Ӧ�ù㷺���о������仯�����Ӧ�������ش�
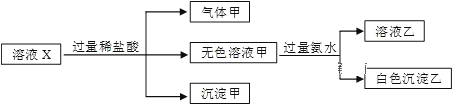
(1)������Ԫ��ֻ�л�ԭ�Ե�������_________��
A��Fe B��FeCl2 C��FeCl3 D��Fe2O3
(2)������ȱ��ʱ��������Ҫ�Բ�������Ʒ�������ܹ����յ���+2�۵���������+2�۵��������ױ�������
����μ���ij���岹��������Ԫ���ѱ�������д���������̡������ۡ�
��____________________________________________________________________��
�ڷ���ά����C����ʹʳ���е�����������ת��Ϊ���������ӡ��ɴ˿���֪��ά����C����________________(�ѧ����)��
(3) �������(K2FeO4)��һ�����͡���Ч�������ɫˮ��������ʪ���Ʊ��������(K2FeO4)�ķ�Ӧ��ϵ������������Fe(OH)3��C1O-��OH-��FeO42-��Cl-��H2O��д������ƽʪ���Ƹ�����ص����ӷ�Ӧ����ʽ��_____Fe(OH)3+_____ClO-+_________=_____FeO42-+_____Cl-+_________
(4)��ҵ�����Ȼ�����ʴͭ���������·�塣ij����ʦΪ�˴�ʹ�ù��ĸ�ʴ��Һ�л���ͭ��������Ȼ������壬���������в��裺

�ش���������:
���Լ�a��___________������I�õ��IJ����������ձ�����������___________��
����ҺX��Z�ж���ͬһ�����ʣ�����ת��Ϊ��ҺW�����ӷ���ʽΪ___________��
�����������в���III����________________��________________�����ˡ�ϴ�ӡ�
���𰸡�A ��ϸ���������ܽ⣬����KSCN��Һ������Һ���ɫ��˵���ѱ����� ��ԭ�� 2 3 4OH- 2 3 5H2O ��(Fe) ©�� 2Fe2++Cl2==2Fe3++2Cl- ����Ũ�� ��ȴ�ᾧ
��������
��1����Ԫ�ش�����ͼ�̬ʱ��ֻ�ܱ��ֻ�ԭ�ԣ��������ԡ�����Ϊ����Ԫ�أ��仯�ϼ���ͼ�Ϊ0�ۣ����Դ�ѡA�
��2���ٸ��������Fe3+�ļ������⡣��Ϊ��Ʒ�ǹ���״̬������������Ҫ��ϡ�����ϡ�����ܽ⣬Ȼ��μ�KSCN��Һ�������Ѫ��ɫ��Һ��˵�����岹��������Ԫ���ѱ�������������������˵���ù��岹��������Ԫ����δ��������
�ڼ���ά����C��ʵ����Fe3+��ΪFe2+�������˻�ԭ��Ӧ������ά�����ǻ�ԭ���������˻�ԭ�ԣ�
��3����Ŀ�Ѹ����μ�������ԭ��Ӧ�����Ͷ�Ӧ�����������ԭ��������ȷ������ϼ۱仯�������Fe(OH)3��FeO4-ǰ��2��ClO-��Cl-ǰ��3����֤��ʧ�����غ㡣Ȼ��Ⱥ�����ĵ�������������4��OH-�����غ㣬������Ҳ���5��H2OʹHԭ���غ㡣
��4����ҵ�����Ȼ�����ʴͭ����ʴ��Һ����Ҫ�ɷ���FeCl3��FeCl2��CuCl2��Ϊ�˻���ͭ������뻹ԭ����ʹͭ����Һ��������Ϊͬʱ����Ȼ�������ͨ����������FeCl2����ΪFeCl3��
���Լ�aΪ��������������Iʵ���˹̡�Һ���룬Ӧ�ǹ��˲�����ʵ������Ҫ�IJ������������ձ��Ͳ������⣬����Ҫ��ͨ©����
����ҺX��Z�ж���FeCl2����ҺW��FeCl3��Һ����ҵ��ͨ��ͨ�����������ʵ����������������Ӧ�Ļ�ѧ����ʽΪ��2FeCl2+Cl2=2FeCl3����Ӧ�����ӷ���ʽΪ��2Fe2++Cl2=2Fe3++2Cl-��
�����������в���III�Ǵ�FeCl3��Һ�л�þ���IJ�����ͨ����Ҫ������Ũ��ʹ��Һ��Ϊ���ͣ�������ͣ���Һ��Ȼ���£���ȴ���ᾧ�����˺��ٽ���ϴ�ӡ�����ȡ�