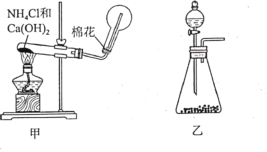
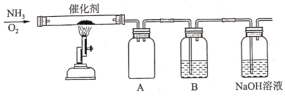
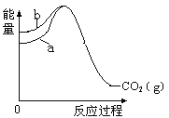
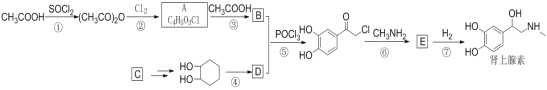
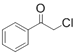
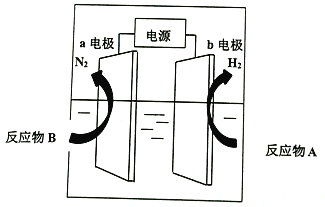
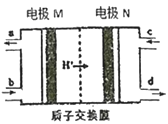
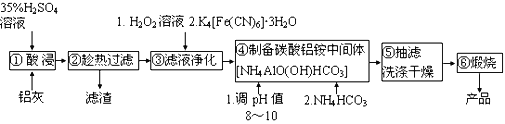
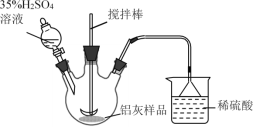
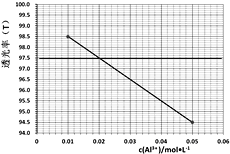
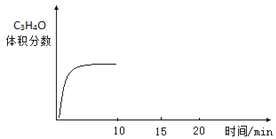
0 199334 199342 199348 199352 199358 199360 199364 199370 199372 199378 199384 199388 199390 199394 199400 199402 199408 199412 199414 199418 199420 199424 199426 199428 199429 199430 199432 199433 199434 199436 199438 199442 199444 199448 199450 199454 199460 199462 199468 199472 199474 199478 199484 199490 199492 199498 199502 199504 199510 199514 199520 199528 203614