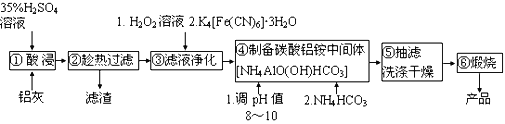
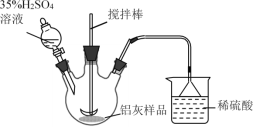
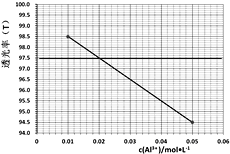
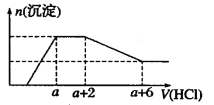
题目内容
【题目】已知:①C(s、金刚石) + O2(g)=CO2(g) ΔH1=-395.4 kJmol-1,② C(s、石墨) + O2(g)=CO2(g) ΔH2=-393.5 kJmol-1 上述反应中的能量变化如图所示,下列说法正确的是
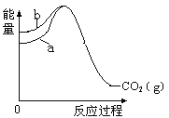
A.石墨和金刚石之间的转化是物理变化
B.图中 b 代表反应①的能量变化
C.C(s、金刚石) =C(s、石墨) ΔH= +1.9 kJmol-1
D.金刚石比石墨的热稳定性好
【答案】B
【解析】
A. 石墨和金刚石是两种不同的单质,石墨和金刚石之间的转化是化学变化,故A错误;
B.b中反应物能量高,代表金刚石,图中b代表反应①的能量变化,故B正确;
C.金刚石转化为石墨是放热过程,C(s、金刚石)=C(s、石墨)ΔH= -1.9 kJmol-1,故C错误;
D.金刚石能量高,金刚石比石墨的热稳定性差,故D错误;
故选B。

练习册系列答案
相关题目
【题目】向20 mL 0.40 mol/L H2O2溶液中加入少量KI溶液:ⅰ.H2O2+I-=H2O+IO﹣;ⅱ.H2O2+IO﹣= H2O+O2↑+ I﹣。H2O2分解反应过程中能量变化和不同时刻测得生成O2的体积(已折算标准状况)如下。

t/min | 0 | 5 | 10 | 15 | 20 |
V(O2)/mL | 0.0 | 12.6 | 20.16 | 28.0 | 32.7 |
下列判断不正确的是
A. 从图中可以看出,KI能增大H2O2的分解速率
B. 反应ⅰ是放热反应,反应ⅱ是吸热反应
C. 0~10 min的平均反应速率:v(H2O2)≈9.0×10-3 mol/(L·min)
D. H2O2在反应过程中既体现了氧化性,又体现了还原性