题目内容
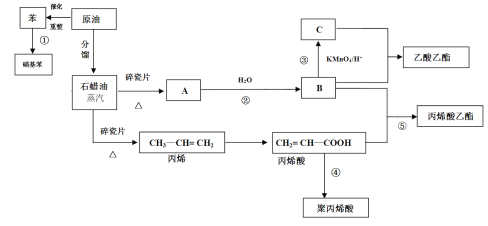
【题目】丙烯腈(C3H3N)是一种重要的化工原料,工业上可用“丙烯氨氧化法”生产。以丙烯、氨、氧气为原料,在催化剂存在下生成丙烯腈(C3H3N)和副产物丙烯醛(C3H4O)的热化学方程式如下。
①C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1
②C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1
请回答下列各题:
(1)关于上述反应,下列说法正确的是____。
A.增大压强有利于提高丙烯腈平衡产率
B.反应②的ΔS等于零
C.可以选择合适的催化剂来提高混合气中丙烯腈的生产效率
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则说明两反应均达到平衡状态
(2)一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,该温度下反应②的平衡常数为____。
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,15min重新达到平衡,请在图中画出10min~20min内C3H4O的百分含量的变化图__________。
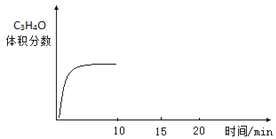
(4)如图为一定时间内丙烯腈产率与反应温度的关系曲线,最高产率对应的温度为460℃。下列说法正确的是_____。

A.460℃之前产率随温度升高而增大是因为随温度升高反应平衡常数变大
B.高于460℃产率下降的原因可能是温度升高催化剂活性降低
C.460℃时C3H6的转化率一定大于500℃
D.温度过高副反应可能变多不利于合成丙烯腈
【答案】CD 3.5  BD
BD
【解析】
(1)关于上述反应的判断,按相关原理进行判断;
(2)按已知条件,结合三段式计算一定温度下反应②的平衡常数;
(3)在图中画出10min~20min内C3H4O的百分含量的变化图,抓住10 min、15 min瞬间C3H4O的百分含量即可;
(4)关于一定时间内丙烯腈产率与反应温度的关系曲线说法的判断,结合图示信息和相应原理判断即可;
(1)A. 生产丙烯腈的反应为:C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,增大压强,平衡左移,则增压不利于提高丙烯腈平衡产率,A错误;
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,增大压强,平衡左移,则增压不利于提高丙烯腈平衡产率,A错误;
B.反应②为C3H6(g)+O2(g)C3H4O(g)+H2O(g) ΔH=353 kJ·mol1,虽然气体分子数目不变,但各物质的熵不同,故ΔS不等于零,B错误;
C.可以选择合适的催化剂极大地提高反应速率,从而提高混合气中丙烯腈的生产效率,C正确;
D.上述反应在恒温、恒容密闭容器中进行,若H2O(g)浓度保持不变,则意味着一定时间内反应中生成水和消耗水的量相等,则说明反应①、②这两反应均达到平衡状态,D正确;
答案为:CD;
(2)已知一定温度下,在体积不变的容器中充入C3H6、NH3、O2各1mol,一定时间后反应达到平衡状态,测得容器内C3H6和H2O的物质的量分别为0.4mol和1.4mol,运用三段式进行计算如下:  ,
, ,则
,则![]() ,解得
,解得![]() ,则②C3H6(g)+O2(g)C3H4O(g)+H2O(g)的平衡常数
,则②C3H6(g)+O2(g)C3H4O(g)+H2O(g)的平衡常数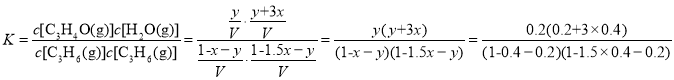 =3.5;
=3.5;
答案为:3.5 ;
(3)若向容器内充入3mol C3H6和1mol O2只发生反应②,一定时间达到平衡状态,10min时再充入1mol O2,则此瞬间C3H4O的百分含量下降,因为增大氧气浓度,平衡向右移动, 15min重新达到平衡,C3H4O的百分含量增大,则10min~20min内C3H4O的百分含量的变化图为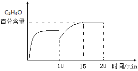 ;
;
答案为: ;
;
(4) 已知生产丙烯腈的反应为:C3H6(g)+NH3(g)+![]() O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,则:
O2(g)C3H3N(g)+3H2O(g) ΔH=515 kJ·mol1,则:
A. 460℃之前产率随温度升高而增大是因为随温度升高反应速率加快,同时生产丙烯腈的反应为放热反应,温度升高反应平衡常数变小,A错误;
B. 催化剂在一定温度范围内活性较高,若温度过高,活性降低,高于460℃产率下降的原因可能是温度升高催化剂活性降低、反应速率变慢,B正确;
C. 460℃时C3H6转化率不一定高于500℃,因为不明确是否处于平衡状态,C错误;
D.温度超过460℃时,产率下降,意味着可能有副反应,则温度过高副反应可能变多不利于合成丙烯腈,D正确;
答案为:BD。

 智慧课堂密卷100分单元过关检测系列答案
智慧课堂密卷100分单元过关检测系列答案 单元期中期末卷系列答案
单元期中期末卷系列答案