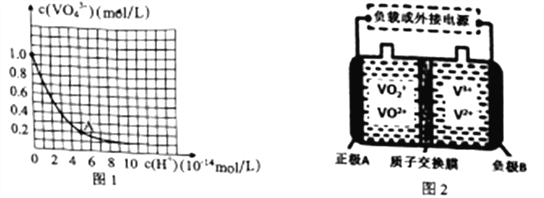
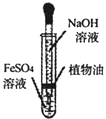
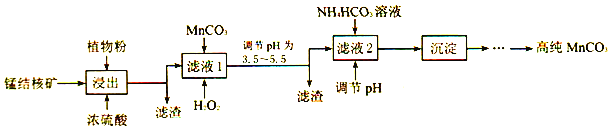
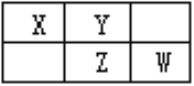
题目内容
【题目】在2A(g)+B(g)![]() 3C(g)+4D(g)反应中,表示该反应速率最快的是( )
3C(g)+4D(g)反应中,表示该反应速率最快的是( )
A. v(B)=0.3mol/(L· s) B. v(A)=0.5mol/(L· min)
C. v(C)=0.8mol/(L· s) D. v(D)=1mol/(L· min)
【答案】A
【解析】
反应速率之比等于化学计量数之比,则反应速率与化学计量数的比值越大,反应速率越快,以此来解答。
反应速率与化学计量数的比值越大,反应速率越快,则
A、v(B)/1=0.3mol/(L·s)÷1=0.3mol/(L·s);
B、v(A)/2=0.5mol/(L·min)÷2=0.25mol/(L·min)=0.0042 mol/(L·s);
C、v(C)/3=0.8mol/(L·s)÷3=0.26 mol/(L·s);
D、v(D)/4=1 mol/(L·min)÷4=0.25 mol/(L·min)=0.042 mol/(L·s)。
显然选项A中比值最大,反应速率最快。
答案选A。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目