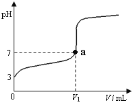
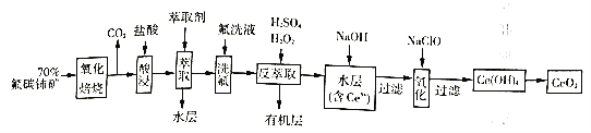
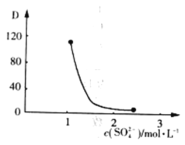
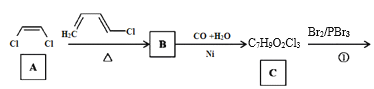
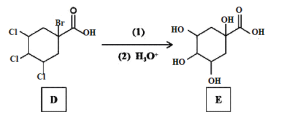
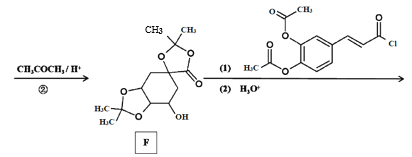
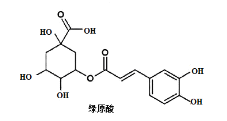
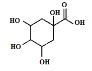
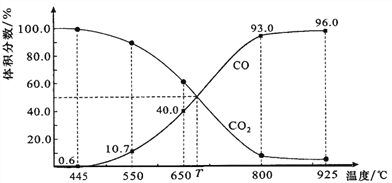
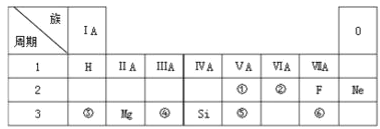
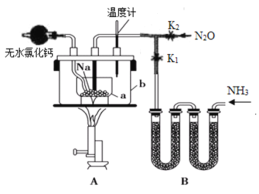
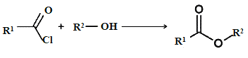0 199158 199166 199172 199176 199182 199184 199188 199194 199196 199202 199208 199212 199214 199218 199224 199226 199232 199236 199238 199242 199244 199248 199250 199252 199253 199254 199256 199257 199258 199260 199262 199266 199268 199272 199274 199278 199284 199286 199292 199296 199298 199302 199308 199314 199316 199322 199326 199328 199334 199338 199344 199352 203614