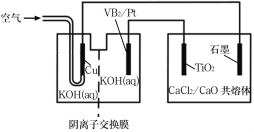
题目内容
【题目】下表是现行中学化学教科书中元素周期表的一部分,除标出的元素外,表中的每个编号表示一种元素,请根据要求回答问题:
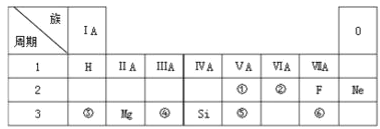
(1)②表示的元素是 ______ (填元素符号)。
(2)①与⑤两种元素相比较,原子半径较大的是______ (填元素符号),其非金属性较强的是 ______ (填元素符号),其最高正价氧化物水化物酸性较强的酸是 ______ (填分子式)。
(3)⑥元素的单质可以用来制取漂白粉,其有效成分是______(填化学式)。
(4)②与⑥元素的氢化物的稳定性:______大于______(填分子式)。
【答案】O P N ![]()
![]() H2O HCl
H2O HCl
【解析】
根据元素周期表写出各元素的符号,再根据层多径大判断半径,从上到下,非金属性减弱。
(1)②表示的元素是O,故答案为O。
(2)①为N,⑤为P,同族元素从上到下原子半径逐渐增大,因此两种元素原子半径较大的是P,非金属性从上到下减弱,其非金属性较强的是N,其最高正价氧化物水化物酸性较强的酸是HNO3,故答案为:P;N;HNO3。
(3)⑥元素的单质是氯气,可以用来制取漂白粉,是氯气与氢氧化钙反应生成氯化钙、次氯酸钙和水,其有效成分是Ca(ClO)2,故答案为:Ca(ClO)2。
(4)氧元素的非金属性强于氯元素,非金属性越强氢化物越稳定,因此H2O稳定性大于HCl,故答案为:H2O;HCl。

【题目】Ⅰ.已知醋酸和盐酸是日常生活中极为常见的酸,在一定条件下,CH3COOH溶液中存在电离平衡:CH3COOH![]() CH3COO-+H+ △H>0。
CH3COO-+H+ △H>0。
(1)下列方法中,可以使0.10 mol/L CH3COOH的电离程度增大的是_______(用序号填写)。
a.加入少量0.10 mol/L的稀盐酸 b.加热CH3COOH溶液
c.加水稀释至0.010 mol/L d.加入少量冰醋酸
e.加入少量氯化钠固体 f.加入少量0.10mol/L的NaOH溶液
(2)将等质量的锌粒投入等体积且pH均等于3的醋酸和盐酸溶液中,经过充分反应后,发现只在一种溶液中有锌粉剩余,则生成氢气的体积关系为V(盐酸)_____V(醋酸)(填写“>”、“<”或“=").
(3)常温下,向体积为VamL,pH为3的醋酸溶液中滴加pH=11的NaOH溶液VbmL至溶液恰好呈中性,则Va与Vb的关系为: Va______Vb(填写“>”、“<”或“=”)。
(4)已知: 某温度时,水的离子积常数为Kw=1.0×10-12,在此温度下,将pH=1的盐酸和pH=11的氢氧化钠溶液等体积混合,则混合溶液中的c(H+)=_______mol/L。
Ⅱ.结合下表回答下列问题(均为常温下的数据):
酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) | 酸 | 电离常数(Ka) |
CH3COOH | 1.8×10-5 | H2CO3 | K1=4.4×10-7 | H2C2O4 | K1=5.4×10-2 | H2S | K1=1.3×10-7 |
HClO | 3×10-8 | K2=4.7×10-11 | K2=5.4×10-5 | K2=7.1×10-15 |
请回答下列问题:
(1) 同浓度的CH3COO-、HCO3/span>-、CO32-、HC2O4-、ClO-、S2-中结合H+的能力最弱的是_________。
(2) 0.1mo1/L的H2C2O4溶液与0.1mo1/L的KOH的溶液等体积混合后所得溶液呈酸性,该溶液中各离子浓度由大到小的顺序为________________。
(3)pH相同的NaC1O和CH3COOK溶液中,[c(Na+)-c(C1O-)]______[c(K+)-c(CH3COO-)](填“>”、“<”或“=”) 。
(4) 向0.1mo1/LCH3COOH 溶液中滴加NaOH 溶液至c(CH3COOH): c(CH3COO-)=5:9,此时溶液pH=_________。