题目内容
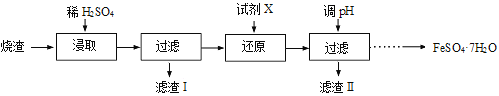
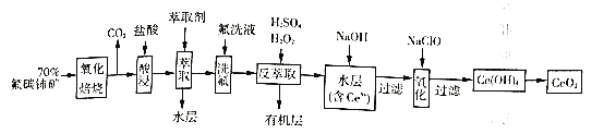
【题目】二氧化铈(![]() )是一种重要的稀土化合物。以氟碳铈矿(主要含
)是一种重要的稀土化合物。以氟碳铈矿(主要含![]() )为原料制备
)为原料制备![]() 的一种工艺流程如图:
的一种工艺流程如图:
已知:①![]() 能与
能与![]() 结合成
结合成![]() ,也能与
,也能与![]() 结合成
结合成![]() ;②
;②![]() 在硫酸体系中能被萃取剂
在硫酸体系中能被萃取剂![]() 萃取,而
萃取,而![]() 不能。回答:
不能。回答:
(1)“氧化培烧”前需将矿石粉碎成细颗粒,其目的是_________。
(2)“酸浸”中会产生大量黄绿色气体,写出![]() 与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
与盐酸反应的离子方程式:____________;为避免产生上述污染,解决方案为__________。
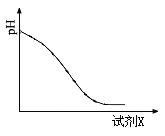
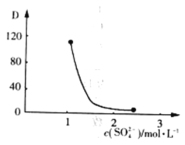
(3)“萃取”时存在反应:![]() 。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示
。实验室中萃取时要用到的主要玻璃仪器名称为__________;图中D是分配比,表示![]() (Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比
(Ⅳ)分别在有机层中与水层中存在形式的物质的量浓度之比![]() 。保持其它条件不变,在起始料液中加入不同量的
。保持其它条件不变,在起始料液中加入不同量的![]() 以改变水层中的
以改变水层中的![]() ,D随起始料液中
,D随起始料液中![]() 变化的原因:_____________。在
变化的原因:_____________。在![]() 的条件下,取
的条件下,取![]() 含四价铈总浓度为
含四价铈总浓度为![]() 的酸浸液,向其中加入
的酸浸液,向其中加入![]() 萃取剂
萃取剂![]() ,充分振荡,静置,水层中
,充分振荡,静置,水层中![]() _________。(结果保留二位有效数字)。
_________。(结果保留二位有效数字)。
(4)“反萃取”中,在稀硫酸和![]() 的作用下
的作用下![]() 转化为
转化为![]() 。
。![]() 在该反应中作用与下列反应中
在该反应中作用与下列反应中![]() 的作用相同的是________。
的作用相同的是________。
A.![]() 处理含酸性重铬酸钾的废水
处理含酸性重铬酸钾的废水
B.![]() 和二氧化锰混合制氧气
和二氧化锰混合制氧气
C.![]() 与氧化钙制过氧化钙
与氧化钙制过氧化钙
D.![]() 在海带提碘实验中的作用
在海带提碘实验中的作用
(5)“氧化”步骤的化学方程式为:___________。
(6)取上述流程中得到的![]() 产品
产品![]() ,加硫酸溶解后,用
,加硫酸溶解后,用![]() 溶液滴定至终点时(铈被还原为
溶液滴定至终点时(铈被还原为![]() ,其他杂质均不反应,
,其他杂质均不反应,![]() 为无色),用
为无色),用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,消耗
,消耗![]() 标准溶液。该产品中
标准溶液。该产品中![]() 的质量分数为________。
的质量分数为________。
【答案】增大固体与气体的接触面积,增大反应速率,提高原料的利用率 ![]() 将
将![]() (盐酸)改用
(盐酸)改用![]() 酸浸 分液漏斗 随着
酸浸 分液漏斗 随着![]() 增大,水层中
增大,水层中![]() 被
被![]() 结合成
结合成![]() ,导致萃取平衡向逆向移动,D迅速减小
,导致萃取平衡向逆向移动,D迅速减小 ![]() A
A ![]()
![]()
【解析】
氟碳铈矿(主要含CeFCO3),“氧化焙烧”的目的是将+3价铈氧化成+4价,Ce4+能与F-结合成[CeFx](4-x)+,以便后续的提取,加稀硫酸,与SO42-结合成[CeSO4]2+,加萃取剂,氟洗液,硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能,“反萃取”加H2O2,又将Ce4+还原为Ce3+,发生反应2Ce4++H2O2=2Ce3++O2↑+2H+,加入碱后Ce3+转化为沉淀,通入氧气讲将e从+3氧化为+4,得到产品,据此回答问题。
(1)“氧化焙烧”前需将矿石粉碎成细颗粒是为了增加固体与氧气接触面积燃烧充分,增大固体和氧气的接触面积,反应更充分;
(2) “酸浸”中会产生大量黄绿色气体应为氯气,CeO2与盐酸发生氧化还原反应生成Ce3+和氯气,可以用硫酸代替盐酸而避免产生氯气污染;
(3) 实验室中萃取时用到的主要玻璃仪器名称为分液漏斗,根据平衡![]() ,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小。在
,加入Na2SO4时,随着c(SO42-)增大,水层中Ce4+被SO42-结合成[CeSO4]2+,导致萃取平衡向左移动,D迅速减小。在![]() 的条件下,
的条件下,![]() ,即
,即![]() ,依据题意,
,依据题意,![]() ×
×![]() =20mL×
=20mL×![]() +
+![]() ×80×
×80×![]() ,
,![]()
![]() 。
。
(4) “反萃取”加H2O2的作用是将Ce4+离子重新还原为Ce3+,H2O2在该反应中作还原剂。
A.![]() 处理含酸性重铬酸钾的废水,过氧化氢做还原剂,A正确;
处理含酸性重铬酸钾的废水,过氧化氢做还原剂,A正确;
B.![]() 和二氧化锰混合制氧气,发生歧化反应,既是氧化剂,又是还原剂,B错误;
和二氧化锰混合制氧气,发生歧化反应,既是氧化剂,又是还原剂,B错误;
C.![]() 与氧化钙制过氧化钙,不发生氧化还原反应,C错误;
与氧化钙制过氧化钙,不发生氧化还原反应,C错误;
D.![]() 在海带提碘实验中作氧化剂,D错误。
在海带提碘实验中作氧化剂,D错误。
答案为A。
(5) “氧化”步骤中用次氯酸钠将Ce3+氧化成Ce4+,反应的化学方程式为![]() 。
。
(6) ![]() 溶液中Fe2+的物质的量为av1×10-3mol,用
溶液中Fe2+的物质的量为av1×10-3mol,用![]() 标准酸性
标准酸性![]() 溶液滴定过量的
溶液滴定过量的![]() ,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,消耗
,反应为MnO4-+5Fe2++8H+=Mn2++5Fe3++4H2O,消耗![]() 标准溶液,即亚铁离子与Ce4+反应了av1×10-3mol-5bv2×10-3mol,根据电子得失守恒可得关系式Ce4+~Fe2+,所以CeO2的质量为(av1×10-3-5bv2×10-3)mol×172g/mol=172 (av1×10-3-5bv2×10-3) g,产品中CeO2的质量分数为
标准溶液,即亚铁离子与Ce4+反应了av1×10-3mol-5bv2×10-3mol,根据电子得失守恒可得关系式Ce4+~Fe2+,所以CeO2的质量为(av1×10-3-5bv2×10-3)mol×172g/mol=172 (av1×10-3-5bv2×10-3) g,产品中CeO2的质量分数为![]() 。
。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案【题目】用石墨电极完成下列电解实验。
实验装置 | 实验现象 |
| a处试纸变蓝; b处变红,局部褪色; c处无明显变化; d处试纸变蓝 |
下列对实验现象的解释或推测不合理的是
A. a为电解池的阴极
B. b处有氯气生成,且与水反应生成了盐酸和次氯酸
C. c处发生了反应:Fe-3e- = Fe3+
D. d处:2H2O+2e-=H2↑+2OH-