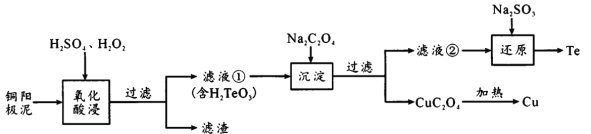
【题目】研究表明,在催化剂a(或催化剂b)存在下,CO2和H2能同时发生两个平行反应,反应的热化学方程式如下:
① CO2(g)+ 3H2(g)![]() CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
CH3OH(g)+ H2O(g) ΔH1= - 53.7 kJ/mol
② CO2(g)+ H2(g)![]() CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
CO(g)+ H2O(g) ΔH2= + 41.2 kJ/mol
某实验小组控制CO2和H2初始投料比为1∶2.2。在相同压强下,经过相同反应时间测得的实验数据如下:
实验编号 | T(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
1 | 543 | 催化剂a | 12.3 | 42.3 |
2 | 543 | 催化剂b | 10.9 | 72.7 |
3 | 553 | 催化剂a | 15.3 | 39.1 |
4 | 553 | 催化剂b | 12.0 | 71.6 |
(备注)甲醇选择性:转化的CO2中生成甲醇的百分比。
下列说法不正确的是
A. 相同温度下,在该时刻催化剂b对CO2转化成CH3OH有较高的选择性
B. 其他条件不变,升高温度反应①中CO2转化为CH3OH平衡转化率增大
C. 其他条件不变,增大反应体系压强反应②中平衡常数不变
D. 反应①在无催化剂、有催化剂a和有催化剂b三种情况下能量示意图如下:

【题目】I.(1)对于下列反应:2SO2 + O2 ![]() 2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
2SO3 , 如果2min内SO2的浓度由8 mol/L下降为2 mol/L,那么,用SO2浓度变化来表示的化学反应速率为____,用O2浓度变化来表示的反应速率为_____________。如果开始时SO2浓度为4mol/L,2min后反应达平衡,若这段时间内v(O2)为0.5mol/(L·min),那么2min时SO2的浓度为_____________。
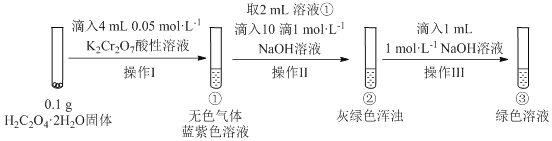
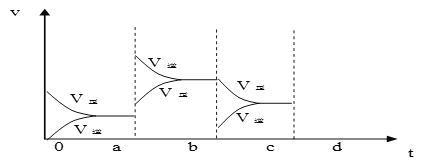
(2)下图表示在密闭容器中反应:2SO2+O2![]() 2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
2SO3 ΔH<0 达到平衡时,由于条件改变而引起反应速度和化学平衡的变化情况,a b过程中改变的条件可能是____________;b c过程中改变的条件可能是____________; 若增大压强时,反应速度变化情况画在c-d处__________.
(3)对于下列电离平衡:NH3·H2O![]() NH4+ + OH -,能使c(NH4+)增大的措施是:_________
NH4+ + OH -,能使c(NH4+)增大的措施是:_________
①升高温度 ②加氨气 ③水 ④ NH4Cl溶液 ⑤NaOH溶液 ⑥适量的盐酸
II.在一定体积的密闭容器中,进行如下化学反应:CO2(g)+H2(g)![]() CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
CO(g)+H2O(g),其化学平衡常数K和温度t的关系如下表:
t℃ | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
回答下列问题:
(1)该反应的化学平衡常数表达式为K=____________;
(2)该反应为____________反应(选填吸热、放热);
(3)某温度下,平衡浓度符合下式:3c(CO2)·c(H2)=5c(CO)·c(H2O),试判断此时的温度为____________℃;
(4)830℃时,向该容器中加入1LCO2与1LH2,平衡时CO2的体积分数是____________。