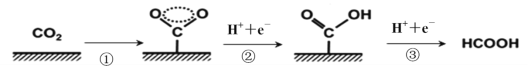
题目内容
【题目】将盛有14 mL由二氧化氮和氧气组成的混合气体的量筒倒立于水槽中,充分反应后剩余4 mL气体(相同状况下测定),原混合气体中二氧化氮和氧气的体积分别是多少?____________________
【答案】二氧化氮8 mL,氧气6 mL或者二氧化氮13.6 mL,氧气0.4 mL
【解析】
可将有关的反应3NO2+H2O=2HNO3+NO和2NO+O2=2NO2整合为4NO2+O2+2H2O=4HNO3,若试管中氧气和二氧化氮气体按体积比1∶4混合,则恰好反应全部溶解,液体充满试管。根据题意剩余4 mL气体,可能氧气过量或者二氧化氮过量,剩余一氧化氮气体。
①若为氧气,则参加反应的气体(O2和NO2)为14 mL-4 mL=10mL,根据4NO2+O2+2H2O=4HNO3可知,二氧化氮的体积为10 mL×![]() =8 mL,参加反应的氧气的体积为10 mL-8mL=2 mL,原混合气体中氧气的体积为2 mL+4 mL=6mL,原混合气体中NO2为8mL;②若二氧化氮过量,剩余一氧化氮气体,根据3NO2+H2O=2HNO3+NO,相当于过量二氧化氮为3×4 mL=12 mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为14 mL-12mL=2 mL,则反应消耗的氧气为2 mL×
=8 mL,参加反应的氧气的体积为10 mL-8mL=2 mL,原混合气体中氧气的体积为2 mL+4 mL=6mL,原混合气体中NO2为8mL;②若二氧化氮过量,剩余一氧化氮气体,根据3NO2+H2O=2HNO3+NO,相当于过量二氧化氮为3×4 mL=12 mL,反应4NO2+O2+2H2O=4HNO3消耗的气体总体积为14 mL-12mL=2 mL,则反应消耗的氧气为2 mL×![]() =0.4 mL,消耗的二氧化氮为2 mL-0.4mL=1.6 mL,原混合气体中二氧化氮的体积为12 mL+1.6mL=13.6 mL,原混合气体中氧气为0.4 mL。
=0.4 mL,消耗的二氧化氮为2 mL-0.4mL=1.6 mL,原混合气体中二氧化氮的体积为12 mL+1.6mL=13.6 mL,原混合气体中氧气为0.4 mL。
故答案为:二氧化氮8mL氧气6 mL或者二氧化氮13.6 mL,氧气0.4 mL。

练习册系列答案
 励耘书业暑假衔接宁波出版社系列答案
励耘书业暑假衔接宁波出版社系列答案
相关题目