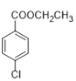
��Ŀ����
����Ŀ��I.��1���������з�Ӧ��2SO2 + O2 ![]() 2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
2SO3 �� ���2min��SO2��Ũ����8 mol/L�½�Ϊ2 mol/L����ô����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊ____����O2Ũ�ȱ仯����ʾ�ķ�Ӧ����Ϊ_____________�������ʼʱSO2Ũ��Ϊ4mol/L��2min��Ӧ��ƽ�⣬�����ʱ����v(O2)Ϊ0.5mol/(L��min)����ô2minʱSO2��Ũ��Ϊ_____________��
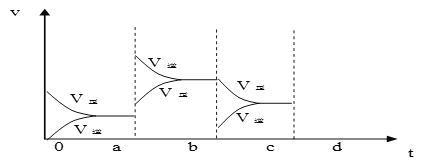
��2����ͼ��ʾ���ܱ������з�Ӧ��2SO2+O2![]() 2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
2SO3 ��H<0 �ﵽƽ��ʱ�����������ı������Ӧ�ٶȺͻ�ѧƽ��ı仯�����a b�����иı������������____________��b c�����иı������������____________�� ������ѹǿʱ����Ӧ�ٶȱ仯�������c-d��__________.
��3���������е���ƽ�⣺NH3��H2O![]() NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
NH4+ + OH -����ʹc(NH4+)����Ĵ�ʩ�ǣ�_________
�������¶� �ڼӰ��� ��ˮ �� NH4Cl��Һ ��NaOH��Һ ������������
II.��һ��������ܱ������У��������»�ѧ��Ӧ��CO2��g����H2��g��![]() CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
CO��g����H2O��g�����仯ѧƽ�ⳣ��K���¶�t�Ĺ�ϵ���±���
t�� | 700 | 800 | 830 | 1000 | 1200 |
K | 0.6 | 0.9 | 1.0 | 1.7 | 2.6 |
�ش��������⣺
��1���÷�Ӧ�Ļ�ѧƽ�ⳣ������ʽΪK��____________��
��2���÷�ӦΪ____________��Ӧ��ѡ�����ȡ����ȣ���
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��3c��CO2����c��H2����5c��CO����c��H2O�������жϴ�ʱ���¶�Ϊ____________�棻
��4��830��ʱ����������м���1LCO2��1LH2��ƽ��ʱCO2�����������____________��
���𰸡�3mol/(L��min) 1.5mol/(L��min) 2mol/L �����¶ȣ� ����SO3Ũ�� 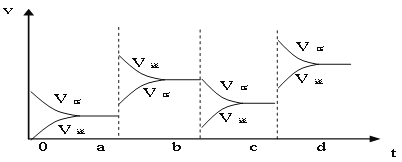 �٢ڢܢ� K=C(CO)��C(H2O)/C(CO2)��C(H2) ���� 700 25%
�٢ڢܢ� K=C(CO)��C(H2O)/C(CO2)��C(H2) ���� 700 25%
��������
I.��1����SO2Ũ�ȱ仯����ʾ�Ļ�ѧ��Ӧ����Ϊv=![]() =
=![]() =3mol/��L��min����v��O2��=
=3mol/��L��min����v��O2��=![]() v��SO2��=1.5mol/��L��min����ͬһ��ѧ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ����Զ�������ķ�Ӧ������������2��Ϊ1mol/��L��min����2min�ڶ�������Ũ�ȵı仯��Ϊ1mol/��L��min����2min=2mol/L������������ƽ��Ũ��=4mol/L-2mol/L=2mol/L��
v��SO2��=1.5mol/��L��min����ͬһ��ѧ��Ӧ��ͬһʱ����ڸ����ʵķ�Ӧ����֮�ȵ����������֮�ȣ����Զ�������ķ�Ӧ������������2��Ϊ1mol/��L��min����2min�ڶ�������Ũ�ȵı仯��Ϊ1mol/��L��min����2min=2mol/L������������ƽ��Ũ��=4mol/L-2mol/L=2mol/L��
��2��aʱ�淴Ӧ���ʴ�������Ӧ���ʣ������淴Ӧ���ʶ�����˵��ƽ��Ӧ���淴Ӧ�����ƶ����÷�Ӧ������Ӧ���ȣ�ӦΪ�����¶ȵĽ����bʱ����Ӧ���ʲ��䣬�淴Ӧ���ʼ�С���ڴ˻�������С��ӦΪ��С�������ԭ��������ѹǿʱ��ƽ��������Ӧ�����ƶ��������淴Ӧ���ʶ�����������Ӧ���ʴ����淴Ӧ���ʣ�ͼ��ӦΪ ��
��
��3���������е���ƽ�⣺NH3��H2O![]() NH4+ +OH -��
NH4+ +OH -��
�������¶ȣ�����ƽ�������ƶ���c(NH4+)������ȷ��
�ڼӰ�������ˮ��Ũ��������ƽ�������ƶ���c(NH4+)������ȷ��
�ۼ�ˮ��ƽ�������ƶ�����c(NH3��H2O)��c(NH4+)��c(OH -)����С���ʴ���
�ܼ���NH4Cl��Һ��ƽ�������ƶ�����笠�����Ũ��������ȷ��
�ݼ���NaOH��Һ������������Ũ������ƽ�������ƶ���c(NH4+)��С���ʴ���
�������������ᣬ���������������к����������ӣ�����������Ũ�ȼ��٣�ƽ�������ƶ���c(NH4+)������ȷ��
��Ϊ�٢ڢܢޣ�
II.��1����ӦCO2��g����H2��g��![]() CO��g����H2O��g����ƽ�ⳣ��������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ���K=
CO��g����H2O��g����ƽ�ⳣ��������������ƽ��Ũ�ȵ��ݴη��˻����Է�Ӧ��ƽ��Ũ���ݴη��˻��õ���K=![]() ��
��
��2��ͼ�����ݷ�����ƽ�ⳣ�����¶���������˵���¶�����ƽ��������У�����Ӧ�����ȷ�Ӧ��
��3��ij�¶��£�ƽ��Ũ�ȷ�����ʽ��3c��CO2����c��H2����5c��CO����c��H2O������K=![]() =
=![]() =0.6�������֪����ʱ���¶�Ϊ700����
=0.6�������֪����ʱ���¶�Ϊ700����
��4��830��ʱ��K=1��
��������м���1L CO2��1L H2����ƽ��ʱת����xL��
��K=![]() =
=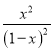 =1��
=1��
x=0.5���ַ�Ӧǰ���������������䣬��Ϊ2L����ƽ��ʱCO2���������Ϊ![]() =25%��
=25%��

����Ŀ���±��������ʣ��������ǵ���Һ��ͨ��һ����Ӧ��ʵ����ͼ��ʾ��ת������
ѡ�� | X | Y | Z |
|
A | Si | Na2SiO3 | H2SiO3 | |
B | S | H2S | SO2 | |
C | Al2O3 | NaAlO2 | Al2(SO4)3 | |
D | Mg(OH)2 | MgCO3 | MgCl2 |
A.AB.BC.CD.D
����Ŀ��������̼�Ļ������ö���������ļ��ž�����Ҫ�����塣��2L�ܱ������У�����2.00molCO2��2.0 mol H2�Լ�����������Ӧ��CO2(g)+H2 (g)![]() HCOOH(g) ��H����ã�n(H2)/mol�ڲ�ͬ�¶���ʱ��ı仯���±���
HCOOH(g) ��H����ã�n(H2)/mol�ڲ�ͬ�¶���ʱ��ı仯���±���
60 min | 90 min | 120 min | 150 min | 180 min | ||
ʵ��I | Tl/K | 1.50 mol | 1.32 mol | 1.28 mol | 1.26 mol | 1.26 mol |
ʵ��� | T2/K | 1.45 mol | 1.20 mol | 1.10 mol | 1.10 mol | 1.10 mol |
(1)�Ƚ�ʵ���¶�T1___T2(����������������)���÷�Ӧ����H___0(������������=����������)��
(2)ʵ��I��0��60 min����HCOOH��ʾ�ĸ÷�Ӧ��ƽ����Ӧ����Ϊ_____��
(3)ʵ���Ӧ��ʼʱ��ϵѹǿΪP0����90minʱ��ϵѹǿΪPl����Pl��P0=___��
(4)�Ƚ�ʵ��I������80minʱ���淴Ӧ���ʴ�Сvl___v��(�����������������������ж���)��ԭ����_____��