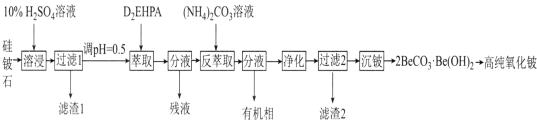
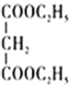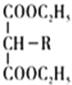【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:
已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。