题目内容
【题目】阅读下面科普信息,回答问题:
一个体重50kg的健康人含铁2g,这2g铁在人体中以Fe2+和Fe3+的形式存在。亚铁离子易被吸收,给贫血者补充铁时,应给予含亚铁离子的亚铁盐,如硫酸亚铁。服用维生素C,可使食物中的铁离子还原成亚铁离子,有利于铁的吸收。
(1)以下为常见的铁元素的几种微粒,其中既有氧化性又有还原性的是_________
A.Fe B.Fe2+ C.Fe3+
(2)工业盐中毒后,可以服用维生素C来缓解中毒状况,这说明维生素C具有______性。
(3)在Fe+4HNO3(稀)═Fe(NO3)3+NO+H2O↑的反应中,用双线桥法表示电子的转移____________,反应中HNO3表现出了______性和______性,则1molFe参加反应时,被还原的HNO3为_________mol,转移电子数为________mol。
【答案】B 还原 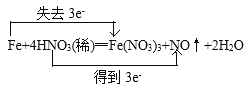 氧化 酸 1 3
氧化 酸 1 3
【解析】
(1)处于中间价态的微粒既有氧化性,也有还原性;
(2)NaNO2把人体内的Fe2+转化为Fe3+,维生素C可以把Fe3+转化为Fe2+;
(3)Fe元素化合价升高,N元素化合价降低,元素化合价升高与降低总数等于反应过程中电子转移数目表示电子转移。根据还原剂失去电子,元素化合价升高;氧化剂获得电子,元素化合价降低判断物质的作用及转移电子数目。
(1)+2价为Fe元素的中间价态,.Fe2+既有氧化性,也有还原性,故合理选项是B;
(2)工业盐中主要成分为NaNO2,NaNO2能够把人体内的Fe2+转化为Fe3+,导致人中毒。维生素C可以把Fe3+转化为Fe2+。Fe元素的化合价降低,获得电子,被还原,维生素C中某元素化合价升高,所以维生素C具有还原性;
(3)在反应Fe+4HNO3(稀)═Fe(NO3)3+NO↑+2H2O中,Fe元素化合价由0价变为+3价,化合价升高,失去电子3e-;N元素化合价由+5价变为NO中的+2价,化合价降低,得到电子3e-,用双线桥法表示电子的转移为: ,在该反应中HNO3一部分得到电子表现氧化性,一部分以NO3-形式与金属阳离子结合形成盐,表现酸性;故硝酸表现出了氧化性和酸性,则1molFe参加反应时,失去3mol电子,1mol HNO3变为NO得到3mol电子,则被还原的HNO3为1mol,转移电子数为3mol。
,在该反应中HNO3一部分得到电子表现氧化性,一部分以NO3-形式与金属阳离子结合形成盐,表现酸性;故硝酸表现出了氧化性和酸性,则1molFe参加反应时,失去3mol电子,1mol HNO3变为NO得到3mol电子,则被还原的HNO3为1mol,转移电子数为3mol。

 期末100分闯关海淀考王系列答案
期末100分闯关海淀考王系列答案 小学能力测试卷系列答案
小学能力测试卷系列答案【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:
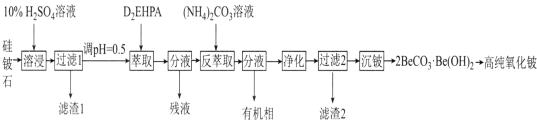
已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。