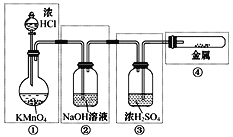
题目内容
【题目】氧化铍(BeO)常温下为不溶于水、易溶于强酸和强碱的固体,除用作耐火材料外,还可以用于制霓虹灯和铍合金。工业上以硅铍石(主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3)制备高纯度BeO的流程如图所示:

已知:①BeO为离子化合物,熔点为2350℃,BeC12和NaC1等比例混合的固体混合物在350℃即可熔化;
②不同金属阳离子在D2EHPA中的溶解性如下表所示:
Be2+ | Mg2+ | Fe3+ | Al3+ | |
D2EHPA中的溶解性 | 易溶 | 难溶 | 微溶 | 微溶 |
请回答下列问题:
(1)“滤渣1”的主要成分为__(填化学式)。“残液”中含量最多的金属元素为__(填名称)。
(2)“萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时含铍微粒发生反应的化学方程式为___。
(3)“净化”时需将反萃取液加热到70℃,加热到70℃的目的为__。
(4)由2BeCO3·Be(OH)2制备高纯BeO的方法是__。
(5)BeO的电子式为__。工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be,不采用电解熔融BeO制备的主要原因为___。
【答案】SiO2 镁 Be(HX2)2+2(NH4)2CO3=(NH4)2Be(CO3)2+2NH4HX2 使被萃取的少量Fe3+和Al3+水解为对应的氢氧化物而被除去 高温煅烧 ![]() BeO熔点高,熔融时能耗高,增加生产成本
BeO熔点高,熔融时能耗高,增加生产成本
【解析】
硅铍石主要含有BeO、SiO2、MgO,还含有少量Al2O3和Fe2O3,SiO2与硫酸反应不反应,加入足量稀硫酸得到BeSO4、MgSO4、Al2(SO4)3、Fe2(SO4)3溶液,滤渣1是SiO2;根据不同金属阳离子在D2EHPA中的溶解性表,“萃取”有机相含有Be(HX2)2及少量Fe3+、Al3+,“反萃取”后Be元素以(NH4)2Be(CO3)2的形式存在于水相中,水相经净化、过滤、沉铍得到2BeCO3·Be(OH)2,2BeCO3·Be(OH)2高温分解得BeO。
(1) BeO、SiO2、MgO、Al2O3和Fe2O3,只有SiO2与硫酸反应不反应,所以“滤渣1”的主要成分为SiO2。根据不同金属阳离子在D2EHPA中的溶解性表,Mg2+难溶于D2EHPA,“残液”中含量最多的金属元素为镁;
(2) “萃取”后铍元素以Be(HX2)2的形式存在于有机相中,“反萃取”后以(NH4)2Be(CO3)2的形式存在于水相中,则“反萃取”时Be(HX2)2和(NH4)2CO3反应生成(NH4)2Be(CO3)2,反应的化学方程式为Be(HX2)2+2(NH4)2CO3=(NH4)2Be(CO3)2+2NH4HX2;
(3) “净化”时需将反萃取液加热到70℃,加热促进水解,加热到70℃的目的是使被萃取的少量Fe3+和Al3+水解为对应的氢氧化物而被除去;
(4) 2BeCO3·Be(OH)2高温分解生成BeO和二氧化碳、水,由2BeCO3·Be(OH)2制备高纯BeO的方法是高温煅烧;
(5)BeO是离子化合物,电子式为![]() ; BeC12和NaC1等比例混合的固体混合物在350℃即可熔化,BeO为离子化合物,熔点为2350℃,BeO熔点高,熔融时能耗高,增加生产成本,所以工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be。
; BeC12和NaC1等比例混合的固体混合物在350℃即可熔化,BeO为离子化合物,熔点为2350℃,BeO熔点高,熔融时能耗高,增加生产成本,所以工业上常采用电解熔融BeC12与NaC1等比例混合物的方法制备金属Be。