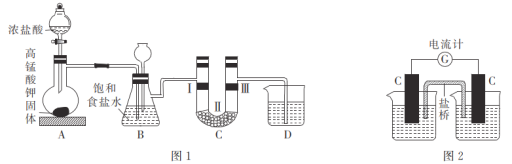
0 198877 198885 198891 198895 198901 198903 198907 198913 198915 198921 198927 198931 198933 198937 198943 198945 198951 198955 198957 198961 198963 198967 198969 198971 198972 198973 198975 198976 198977 198979 198981 198985 198987 198991 198993 198997 199003 199005 199011 199015 199017 199021 199027 199033 199035 199041 199045 199047 199053 199057 199063 199071 203614