题目内容
【题目】某化学兴趣小组设计装置,进行实验探究KMnO4与浓盐酸的反应。
[实验1]设计如图1所示装置,并验证氯气的漂白性。
(1)高锰酸钾与浓盐酸的反应中,浓盐酸表现出的性质是_________;若实验中产生2.24 L(标准状况)Cl2,设NA为阿伏加德罗常数的值,则转移的电子数为___________。
(2)利用装置C验证氯气是否具有漂白性,则装置中I、II、III处依次放入的物质可能是__________________。
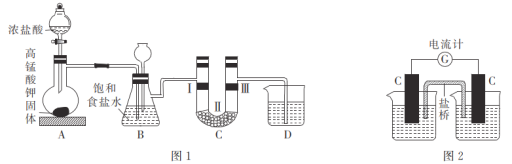
[实验2]设计如图2所示装置,左侧烧杯中加入100 mL由2.00 mol·L-1 KMnO4和6 mol·L-1 H2SO4组成的混合溶液,右侧烧杯中加入100 mL 5.00 mol·L-1 BaCl2溶液,盐桥选择KNO3琼脂。
(3)若用98%的浓硫酸(密度为1.84 g·cm-3)配制500 mL 6 mol·L-1的稀硫酸时,除了需用到玻璃棒、烧杯、量筒之外,还必须用到的玻璃仪器为____________;下列操作会导致所配溶液浓度偏小的是____________(填字母)。
A.容量瓶内壁附有水珠却未干燥处理 B.加水定容时俯视刻度线
C.颠倒摇匀后发现凹液面低于刻度线又加水补足 D.稀释过程中有少量液体溅出烧杯外
(4)左侧烧杯中石墨电极上的电极反应式为________________________________;盐桥中的K+移向____________ (填“左”或“右”)侧烧杯的溶液中。
(5)实验发现,其他条件不变,改用10.0 mol·L-1 H2SO4时,生成氯气的速率比使用6 mol·L-1 H2SO4时快且产生的气体体积更大,其可能的原因是______________________________。
【答案】酸性、还原性 0.2NA 湿润的有色布条、无水氯化钙、干燥的有色布条 500mL容量瓶、胶头滴管 CD MnO![]() +5e-+8H+=Mn2++4H2O 左 氢离子浓度大,KMnO4的氧化性增强,反应速率快能氧化更多的氯离子
+5e-+8H+=Mn2++4H2O 左 氢离子浓度大,KMnO4的氧化性增强,反应速率快能氧化更多的氯离子
【解析】
[实验1](1)高锰酸钾与浓盐酸反应制备Cl2时,HCl部分被氧化,生成了Cl2,体现出了还原性;生成了KCl和MnCl2,体现出酸性;
(2)氯气溶于水生成的HClO具有漂白性,利用饱和食盐水除去HCl的氯气中含有水蒸气,因此先通过湿润的有色布条,探究氯气是否有漂白性;
[实验2](4)KMnO4能够氧化HCl生成Cl2,KMnO4在此过程中得到电子,发生还原反应,左侧石墨电极为正极;
(5)一般条件下,酸性越强,氧化性越强,KMnO4与HCl的反应速率越快。
[实验1](1)高锰酸钾和浓盐酸制备Cl2的化学方程式为2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O,HCl中有一部分Cl的化合价升高,生成了Cl2,体现出了还原性;有一部分化合价没有变化,形成了KCl和MnCl2,体现出了酸性;根据化学方程式生成5molCl2转移10mol电子,若产生的了2.24L即0.1molCl2,则转移的电子的物质的量为0.2mol,其数目为0.2NA;
(2)装置A生成Cl2,利用饱和食盐水除去Cl2中的HCl,经过B装置的氯气中含有水蒸气,因此先经过湿润的有色布条,再干燥,在经过干燥的有色布条;因此I为湿润的有色布条,Ⅲ为干燥的有色布条,Ⅱ为无水氯化钙,用于干燥Cl2;
[实验2](3)用浓硫酸配制一定物质的量浓度的硫酸时,量取浓硫酸时需要量筒,浓硫酸稀释时,需要烧杯和玻璃棒;转移时,需要500mL容量瓶,定容时需要胶头滴管;因此还需要的玻璃仪器有500mL容量瓶、胶头滴管;
A.容量瓶内壁有水珠未干燥,对溶液中的硫酸的物质的量和溶液的体积均无影响,浓度不变,A不符合题意;
B.加水定容时,俯视刻度线,体积偏小,硫酸的浓度偏大,B不符合题意;
C.颠倒摇匀后,凹液面低于刻度线又补加水,相当于稀释,所配溶液浓度偏小,C符合题意;
D.稀释过程中,有少量液体溅出,则容量瓶溶液中的溶质减小,所配溶液浓度偏小,D符合题意;
答案选CD;
(4)利用原电池制备Cl2,左侧加入的KMnO4和H2SO4,KMnO4得到电子转化为Mn2+,其电极反应式为MnO4-+5e-+8H+=Mn2++4H2O;在原电池中,阳离子向正极移动,左侧KMnO4得到电子发生还原反应,则左侧的石墨电极为正极,则K+向左移动;
(5)在一般情况下,酸性越强,氧化性越强;硫酸的浓度越大,氢离子浓度越大,高锰酸钾的氧化性越强,化学反应速率越快,能氧化更多的氯离子。

 阅读快车系列答案
阅读快车系列答案【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
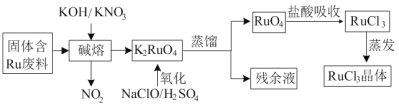
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
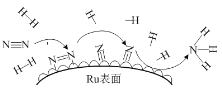
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。