题目内容
【题目】在一定温度下,10L密闭容器中加入5.0molSO2、4.5molO2,经10min后反应达平衡时O2的浓度为0.30mol/L。请计算(写出计算过程):
(1)10min内SO2的转化率;
(2)容器内反应前与平衡时的压强之比(最简整数比) ;
(3)平衡常数K。
【答案】(1)60%;(2)19:16(3)7.5。
【解析】
(1)根据化学方程式列比例进行计算。平衡时氧气的物质的量为0.30mol/L×10L=3.0mol。
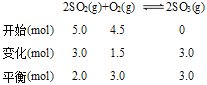
10min内SO2的转化率=![]() ×100%=60%。
×100%=60%。
(2)同温同体积下,压强和气体的物质的量成正比,容器内反应前与平衡时的压强之比=(5.0+4.5):(2.0+3.0+3.0)=9.5:8.0=19:16。
(3)化学反应平衡常数K=![]() 。
。

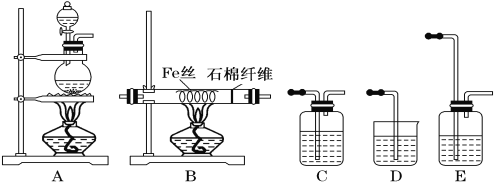
【题目】正丁醚常用作有机反应的溶剂。实验室制备正丁醚的反应和主要实验装置如下:
2CH3CH2CH2CH2OH (CH3CH2CH2CH2)2O+H2O
(CH3CH2CH2CH2)2O+H2O

反应物和产物的相关数据如下:
相对分子质量 | 沸点/℃ | 密度/(g·cm-3) | 水中溶解性 | |
正丁醇 | 74 | 117.2 | 0.8109 | 微溶 |
正丁醚 | 130 | 142.0 | 0.7704 | 几乎不溶 |
合成反应:
①将一定量的浓硫酸和正丁醇,按一定顺序添加到A中,并加几粒沸石。
②加热A中反应液,迅速升温至135℃,维持反应一段时间。
分离提纯:
③待A中液体冷却后将其缓慢倒入盛有一定量水的分液漏斗中,振摇后静置,分液得粗产物。
④粗产物依次用蒸馏水、NaOH溶液和蒸馏水洗涤,分液后再加入一定质量的无水氯化钙颗粒,静置一段时间后弃去氯化钙。
⑤将上述处理过的粗产物进行蒸馏,收集馏分,得正丁醚。
请回答:
(1)步骤①中浓硫酸和正丁醇的添加顺序为________。
(2)加热A前,需先从________(填“a”或“b”)口向B中通入水。
(3)步骤②中,若温度控制不当,最容易产生副产物的结构简式为________。
(4)分液漏斗在使用前须清洗干净并________,步骤③中粗产物应从分液漏斗的________(填“上”或“下”)口分离出。
(5)步骤④中加入NaOH溶液洗涤的目的为________。
(6)步骤⑤中,加热蒸馏时应收集________(填选项字母)左右的馏分。
a.100℃ b.117℃ C.135℃ d.142℃
(7)反应过程中会观察到分水器中收集到液体物质,且分为上下两层,随着反应的进行,分水器中液体逐渐增多至充满时,上层液体会从左侧支管自动流回A。分水器中上层液体的主要成分为________,下层液体的主要成分为________。