题目内容
【题目】锌、铁、铜及其化合物在生活、生产中有着广泛应用。回答下列问题:
(1)基态Fe3+的核外电子排布式为____________。在第四周期过渡元素中,基态原子未成对电子数最多的元素为____________(用元素符号表示)。
(2)一水合甘氨酸锌[(H2NCH2COO)2Zn·H2O]是一种饲料添加剂,该化合物中所涉及的非金属元素电负性由大到小的顺序是____________(用元素符号表示);甘氨酸分子中N原子的杂化轨道类型为____________;从结构角度解释甘氨酸易溶于水的原因:________________。
(3)铜元素的第一电离能、第二电离能分别为746 kJ·mol-1、1958 kJ·mol-1;锌元素的第一电离能、第二电离能分别为906 kJ·mol-1、1733 kJ·mol-1,铜的第二电离能大于锌的第二电离能,其主要原因是___________________________________________________。
(4)磷酸铁(FePO4)可用于制造磷酸铁锂电池材料,PO![]() 的空间构型为______________。
的空间构型为______________。
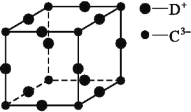
(5)某种化合物由Fe、Cu、S三种元素组成,其晶胞结构如图所示,则化学式为__________,该晶胞上、下底面均为正方形,侧面与底面垂直,若该晶体的密度ρ g·cm-3,设NA为阿伏加德罗常数的值,结合图中的数据计算底面棱长a=____________(只要求列出计算式,用含b的代数式表示)pm。

【答案】[Ar]3d5 Cr O>N>C>H sp3 甘氨酸是极性分子,氨基和羧基都能与水分子形成氢键 气态Cu失去一个电子变成Cu+后,其核外价电子排布式为3d10,形成了较稳定的全充满状态;而锌失去一个电子后,其核外价电子排布式为3d104s1 正四面体 CuFeS2 
【解析】
(1)Fe为26号元素,其核外电子排布为1s22s22p63s23p63d64s2,失去3个电子形成Fe3+,其核外电子排布为1s22s22p63s23p63d5或[Ar]3d5;在3d过渡金属中,基态原子未成对电子数最多的元素的价电子排布式为3d54s1,该元素为Cr;
(2)一水合甘氨酸锌中含有的非金属元素有H、C、N、O,元素的非金属性越强,其电负性越大,非金属性大小顺序为O>N>C>H,则电负性大小排序为O>N>C>H;甘氨酸的结构简式为NH2CH2COOH,-NH2中N原子的价层电子对个数为4,则N原子的杂化类型为sp3;根据甘氨酸的结构简式,其含有-NH2、-COOH能够与水形成氢键,且甘氨酸是极性分子;
(3)气态Zn失去一个电子形成排布为[Ar]3d104s1的结构;而气态Cu失去一个电子变成Cu+,其核外电子排布式为为[Ar]3d10,Cu+的核外电子排布中3d轨道为全满结构,较稳定,再失去一个电子,需要的能量较高;答案为气态Cu失去一个电子变成Cu+后,其核外价电子排布式为3d10,形成了较稳定的全充满状态;而锌失去一个电子后,其核外价电子排布式为3d104s1;
(4)PO43-中P的价层电子对数目=![]() ,价层电子对数目为4,不含孤对电子对,则PO43-的空间构型为正四面体;
,价层电子对数目为4,不含孤对电子对,则PO43-的空间构型为正四面体;
(5)晶胞内含有8个S,均为此晶胞所有,则此晶胞含有8个S;晶胞的8个顶点为Cu所占有,为8个晶胞所共有,面上有4个Cu,为2个晶胞所共有,还有1个Cu在晶胞内部,为此晶胞所共有,则此晶胞中一共含有![]() 个Cu;晶胞的4个棱上有Fe,为4个晶胞所共有,面上有6个Fe,为2个晶胞所共有,则此晶胞中一共含有
个Cu;晶胞的4个棱上有Fe,为4个晶胞所共有,面上有6个Fe,为2个晶胞所共有,则此晶胞中一共含有![]() 个Fe;则此晶胞中Cu、Fe、S的个数比为4:4:8=1:1:2,则此化学式为CuFeS2;
个Fe;则此晶胞中Cu、Fe、S的个数比为4:4:8=1:1:2,则此化学式为CuFeS2;
晶胞的密度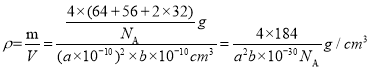 ,可得
,可得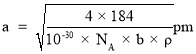 。
。

【题目】为了合理利用化学能,确保安全生产,化工设计需要充分考虑化学反应的反应热,并采取相应措施.化学反应的反应热通常用实验进行测定,也可进行理论推算.
(1)实验测得,5g甲醇(CH3OH)液体在氧气中充分燃烧生成二氧化碳气体和液态水时释放出113.5kJ的热量,则表示甲醇标准燃烧热的热化学方程式为:__________.
(2)今有如下两个热化学方程式:则a______b(填“>”、“=”或“<”)
H2(g)+![]() O2(g)=H2O(g)△H1=akJmol-1
O2(g)=H2O(g)△H1=akJmol-1
H2(g)+![]() O2(g)=H2O(l)△H2=bkJmol-1
O2(g)=H2O(l)△H2=bkJmol-1
(3)拆开1mol气态物质中某种共价键需要吸收的能量叫键能.从化学键的角度分析,化学反应的过程就是反应物的化学键的破坏和生成物的化学键的形成过程.在化学反应过程中,拆开化学键需要消耗能量,形成化学键又会释放能量.
化学键 | H-H | N-H | N≡N |
键能/kJmol-1 | 436 | 391 | 945 |
已知反应N2(g)+3H2(g)=2NH3(g)△H=akJmol-1.试根据表中所列键能数据估算a的值:____________(注明“+”或“-”).
(4)依据盖斯定律可以对某些难以通过实验直接测定的化学反应的反应热进行推算.利用水煤气合成二甲醚的三步反应如下:
①2H2(g)+CO(g)=CH3OH(g);△H=-90.8kJmol-1
②2CH3OH(g)=CH3OCH3(g)+H2O(g);△H=-23.5kJmol-1
③CO(g)+H2O(g)=CO2(g)+H2(g);△H=-41.3kJmol-1
总反应:3H2(g)+3CO(g)=CH3OCH3(g)+CO2(g)的△H=________________.
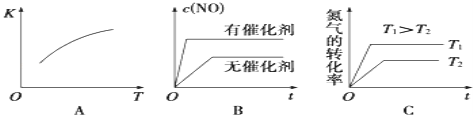
(5)汽车尾气里含有的NO气体是由于内燃机燃烧的高温引起氮气和氧气反应所致:N2(g)+O2(g)2NO(g)△H>0,已知该反应在2 404℃,平衡常数K=64×10﹣4.请回答:
①将N2、O2的混合气体充入恒温恒容密闭容器中,如图变化趋势正确的是_____(填字母序号).
②该温度下,某时刻测得容器内N2、O2、NO的浓度分别为2.5×10﹣1 mol/L、4.0×10﹣2 mol/L和3.0×10﹣3 mol/L,此时反应_______(填“处于化学平衡状态”、“向正反应方向进行”或“向逆反应方向进行”),理由是_______.