题目内容
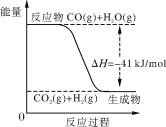
【题目】已知工业制氢气的反应为CO(g)+H2O(g) ![]() CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
CO2(g)+H2(g),反应过程中能量变化如下图所示。在500 ℃时的平衡常数K=9。若在2 L的密闭容器中CO和水蒸气的起始浓度都是0.1 mol/L,10 min时达到平衡状态。
(1)增加H2O(g)的浓度,CO的转化率将________(填“增大”、“减小”或“不变”)。
(2)平衡常数的表达式K=________。400 ℃时平衡常数K______9(填“>”、“<” 或“=”)。
(3)已知2H2(g)+O2(g) ![]() 2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
2H2O (g) ΔH=-484 kJ/mol。结合上图写出CO完全燃烧生成CO2的热化学方程式:____。
【答案】增大 c(CO2)c(H2)/ c(CO)c(H2O) > 2CO(g) + O2(g) = 2CO2(g) ΔH=—566KJ/mol
【解析】
(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,从图上可见反应放热,降温平衡正向移动,K增大;
(3)利用盖斯定律,从待求反应出发,分析待求反应中的反应物和生成物在已知反应中的位置,通过相互加减可得。
(1)增大反应物H2O(g)的浓度,平衡正向移动,CO的转化率增大;
(2)化学平衡常数是用生成物浓度的幂次方除以反应物浓度的幂次方,所以K=![]() ;从图上可见反应放热,降温平衡正向移动,K增大,即400 ℃时平衡常数K>9;
;从图上可见反应放热,降温平衡正向移动,K增大,即400 ℃时平衡常数K>9;
(3)已知:①CO(g)+H2O(g)CO2(g)+H2(g)△H=-41KJ/mol,②2H2(g)+O2(g)2H2O(g)△H=-484kJ/mol,据盖斯定律①×2+②得:2CO(g)+O2(g)=2CO2(g)△H=-566KJ/mol。

 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】三氯化钌广泛应用于氯碱工业中金属阳极钌涂层及加氢催化剂。现以固体含Ru废料为原料制备RuCl3晶体,其工艺流程如下:
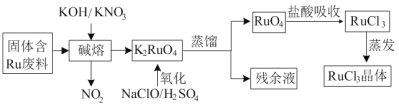
回答下列问题:
(1)K2RuO4中Ru的化合价为_____,“碱熔”中产生的气体可用于____(写一种工业用途)。
(2)“氧化”时欲使2mol K2RuO4氧化为RuO4,则需要氧化剂的物质的量为______mol。
(3)为了提高“碱熔”效率,可以采取的措施有______。
(4)RuO4气体有剧毒,“盐酸吸收”时的化学方程式为___________。
(5)可用氢还原重量法测定产品的纯度,其原理为2RuCl3+3H2 = 2Ru+6HCl,所得实验数据记录如下:
实验序号 | 产品质量/g | 固体Ru质量/g |
① | 5.1875 | 2.0210 |
② | 5.1875 | 2.0190 |
③ | 5.1875 | 2.0200 |
④ | 5.1875 | 1.6200 |
则产品的纯度为________(用百分数表示)。
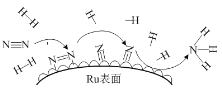
(6)钌及其化合物在合成工业上有广泛用途,根据图示写出合成反应的化学方程式________。