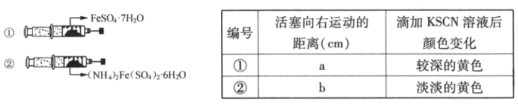
题目内容
【题目】CH3OCH3(二甲醚)常用作有机合成的原料,也用作溶剂和麻醉剂。CO2与H2合成CH3OCH3涉及的相关热化学方程式如下:
Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
CH3OH(g)+H2O(g) ΔH1=-49.1kJ·mol-1
Ⅱ.2CH3OH(g)![]() CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
CH3OCH3(g)+H2O(g) ΔH2=-24.5kJ·mol-1
Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g) ΔH3
CO(g)+H2(g) ΔH3
Ⅳ.2CO2(g)+6H2(g)![]() CH3OCH3(g)+3H2O(g) ΔH4
CH3OCH3(g)+3H2O(g) ΔH4
回答下列问题:
⑴ΔH4=__kJ·mol-1。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行。反应Ⅰ、Ⅱ、Ⅲ的自由能变与温度的关系如图a所示,在298~998K下均能自发进行的反应为__(填“Ⅰ”“Ⅱ”或“Ⅲ”)。

⑶在三个完全相同的恒容密闭容器中,起始时均通入3molH2和1molCO2,分别只发生反应Ⅰ、Ⅲ、Ⅳ时,CO2的平衡转化率与温度的关系如图b所示。
①ΔH3__0(填“>”或“<”)。
②反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为p(CO2)__pMPa(精确到0.01)。
③在B点对应温度下, K(Ⅰ)__(填“大于”“小于”或“等于”)K(Ⅲ)。
⑷向一体积为1L的密闭容器中通入H2和CO2,只发生反应Ⅳ。CO2的平衡转化率与压强、温度及氢碳比m[m=![]() ]的关系分别如图c和图d所示。
]的关系分别如图c和图d所示。

①图c中压强从大到小的顺序为__,图d中氢碳比m从大到小的顺序为__。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%,则在此温度下该反应的平衡常数K=__(保留整数)。
【答案】-122.54 Ⅱ > 0.21 小于 p1>p2>p3 m1>m2>m3 23
【解析】
⑴第Ⅰ个方程式的2倍加上第Ⅱ个方程式。
⑵根据图中信息得到298~998K下只有Ⅱ的ΔG<0。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应;②三段式式建立关系,根据公式求出压强;③根据平衡常数分析产物与反应物的关系。
⑷①利用转化率分析压强,利用一个量不变,另一个量变化来分析。
②建立三段式建立再求平衡常数。
⑴将第Ⅰ个方程式的2倍加上第Ⅱ个方程式得到ΔH4=-122.54 kJ·mol1;故答案为:-122.54。
⑵体系自由能变ΔG=ΔH-TΔS,ΔG<0时反应能自发进行,在298~998K下只有Ⅱ的ΔG<0,因此均能自发进行的反应为Ⅱ;故答案为:Ⅱ。
⑶①升高温度,CO2的平衡转化率增大,说明平衡正向移动,正向是吸热反应,即ΔH3>0;故答案为:>。
②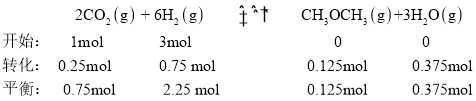 ,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为
,反应Ⅳ,若A点总压强为pMPa,则A点时CO2的分压为![]() ;故答案为:0.21。
;故答案为:0.21。
③在B点对应温度下,根据Ⅰ.CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)
CH3OH(g)+H2O(g)和Ⅲ.CO2(g)+H2(g)![]() CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
CO(g)+H2(g)的反应,CO2转化率相等,产物的量相等,但Ⅰ中氢气平衡时量较少,但是大于1的值,由于是浓度三次方,因此平衡常数小,平衡常数K(Ⅰ)小于K(Ⅲ);故答案为:小于。
⑷①该反应是体积减小的反应,图c中定温度,从下到上看,转化率增大,说明平衡正向移动,向体积减小方向移动即加压,压强从大到小的顺序为p1>p2>p3,图d中可以理解为二氧化碳物质的量不变,氢气量不断增加,平衡正向移动,二氧化碳转化率不断增大,因此氢碳比m从大到小的顺序为m1>m2>m3;故答案为:m1>m2>m3。
②若在1L恒容密闭容器中充入0.2molCO2和0.6molH2,CO2的平衡转化率为50%, ,则在此温度下该反应的平衡常数
,则在此温度下该反应的平衡常数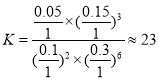 ;故答案为:23。
;故答案为:23。

【题目】近年科学家提出“绿色自由”构想。把空气中的CO2进行转化,并使之与H2反应生成可再生能源甲醇。
(1)工业生产中可利用H2还原CO2制备清洁能源甲醇。
①下列关于氢能的说法正确的是____。
A.氢能是清洁能源 B.氢能是二次能源
C.氢能是不可再生能源 D.气态氢能源更容易保存和运输
②已知CO(g)和H2(g)的燃烧热(△H)分别为-283.0kJmol-1、-285.8kJmol-1。CO与H2合成甲醇的能量变化如图甲所示:
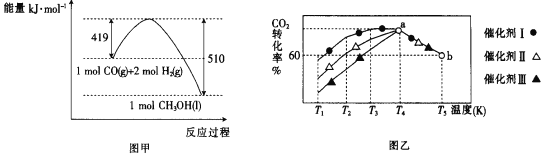
则用CO2(g)和H2(g)制备液态甲醇的热化学方程式为____。
③将一定量的CO2和H2充入到某恒容密闭容器中,测得在不同催化剂作用下,相同时间内CO2的转化率与温度的变化如图乙所示:催化效果最好的是催化剂____(选填“Ⅰ”“Ⅱ”或“Ⅲ”)。
(2)利用CO和水蒸气可生产H2,反应的化学方程式:CO(g)+H2O(g)CO2(g)+H2(g)。将不同量的CO(g)和H2O(g)分别通入到体积为2L的恒容密闭容器中进行如下反应,得到三组数据如表所示:
温度/℃ | 起始量 | 达到平衡 | |||
CO/mol | H2O/mol | H2/mol | CO转化率 | 时间/min | |
650 | 4 | 2 | 1.6 | 10 | |
900 | 3 | 2 |
| 5 | |
900℃时,达到平衡时的反应速率v(H2O)=____。(保留2位小数)。
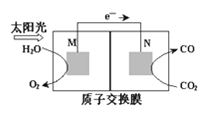
(3)科学家还研究了其他转化温室气体的方法,利用如图所示装置可以将CO2转化为气体燃料CO。该装置工作时,N电极的电极反应式为____。
【题目】如表所示,对陈述Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 | 陈述Ⅰ | 陈述Ⅱ | 判断 |
A | 碳酸钠溶液可用于治疗胃病 |
| Ⅰ对,Ⅱ对,有 |
B | 向滴有酚酞的水溶液中加入 |
| Ⅰ对,Ⅱ错,无 |
C | 分别加热 | 两种物质均受热分解 | Ⅰ对,Ⅱ对,有 |
D | 过氧化钠可为航天员供氧 |
| Ⅰ对,Ⅱ对,有 |
A.AB.BC.CD.D