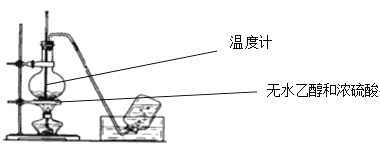
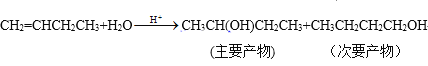
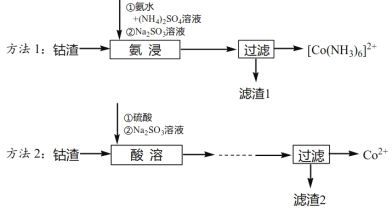
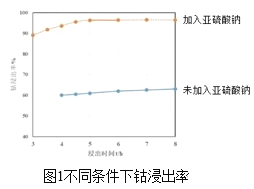
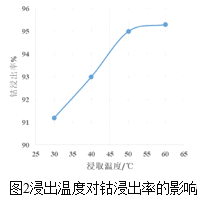
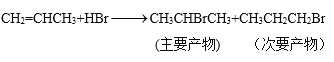【题目】某一反应体系有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2→O2
(1)该反应中的还原剂是____________。
(2)该反应中,发生还原反应的过程是______________→____________。
(3)写出该反应的化学方程式,并标出电子转移的方向和数目_____________。
(4)如反应转移了0.3 mol电子,则产生的气体在标准状况下的体积为 。
(5)已知I-、Fe2+、SO2、Cl-、H2O2均有还原性,它们在酸性溶液中还原性的强弱顺序为:SO2>I->H2O2>Fe2+>Cl-,则下列反应不能发生的是( )
A.2Fe3++SO2+2H2O=2Fe2++SO42-+4H+ |
B.I2+SO2+2H2O=H2SO4+2HI |
C.H2O2+H2SO4=SO2↑+O2↑+2H2O |
D.2Fe3++2I-=2Fe2++I2 |
【题目】亚硝酰氯(ClNO)是有机物合成中的重要试剂,可由NO与Cl2在常温常压下反应得到。ClNO部分性质如下:黄色气体,熔点:-59.6℃,沸点:-6.4℃,遇水易水解。某研究性学习小组根据亚硝酰氯(ClNO)性质拟在通风橱中制取亚硝酰氯,设计了如下实验装置。、

试回答下列问题:
(1)写出实验室利用装置A制备Cl2的离子反应方程式___。
(2)装置B的作用是①__,②___。
(3)若用A装置制取NO气体,B中应该盛放__。
(4)为使NO和Cl2恰好完全反应生成ClNO,理论上向E中通入NO和Cl2两种气体的流速比为__。
(5)装置H吸收尾气,有同学认为尾气中的某种气体不能完全被吸收。为了充分吸收尾气,可将尾气与__同时通入NaOH溶液中。
(6)已知:ClNO与H2O反应生成HNO2和HCl。
①设计实验证明HNO2是弱酸:__。(仅提供的试剂:1molL-1HCl、1molL-1HNO2溶液、NaNO2溶液、红色石蕊试纸、蓝色石蕊试纸)。
②通过以下实验测定ClNO样品的纯度。取F中所得液体3.0g溶于水,配制成250mL溶液;取出25.00mL样品溶液置于锥形瓶中,用0.20molL-1AgNO3标准溶液滴定至终点,根据表中所给信息,应选用___做指示剂。
物质 | Ag2CrO4 | AgCl | AgI | Ag2S |
颜色 | 砖红色 | 白色 | 黄色 | 黑色 |
Ksp | 1×10-12 | 1.56×10-10 | 8.3×10-17 | 6.3×10-50 |
消耗标准AgNO3溶液的体积为20.00ml,亚硝酰氯(ClNO)的质量分数为__。