题目内容
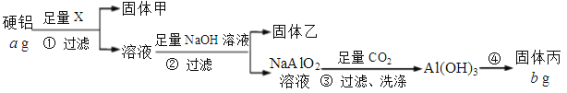
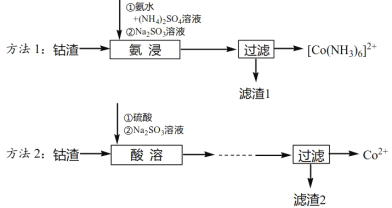
【题目】工业上从钴渣[含Co(OH)3、Fe(OH)3等]中回收钴的两种方法如下:
已知:
①Ksp[Co(OH)3]=1.6×10-44,Ksp[Co(OH)2]=6.3×10-15,Ksp[Fe(OH)3]=4.0×10-38。
②碱性条件下,Fe(OH)3不与亚硫酸钠反应;Fe3++NH3→不发生类似Co2+、Co3+的配位化学反应。
请回答下列问题:
(1)方法1“氨浸”时用的氨水的质量百分数为a,密度为ρg·cm-3,该氨水的物质的量浓度为_____mol·L-1,“氨浸”过程中发生反应的离子方程式为_______。
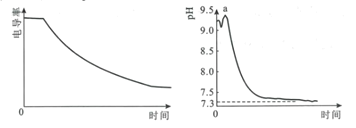
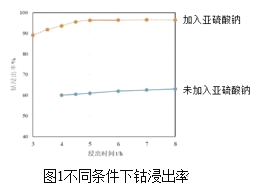
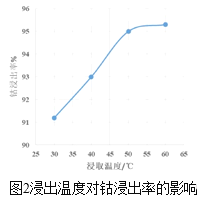
(2)方法1“氨浸”时,未加Na2SO3溶液和加入Na2SO3溶液时的钴浸出率如图1所示。请解释两种情况下钴浸出率不同的原因:______。
(3)方法1中,浸出温度对钴浸出率的影响如图2所示,工业上选择50℃而不是更高温度的可能的原因是_____。
(4)方法2中,为提高酸溶速率,可采取的措施是______(写出一条即可)。
(5)对比方法1和方法2,从物质分离的角度分析方法1的优点是_____。
【答案】![]() 2Co(OH)3+8NH3+ SO
2Co(OH)3+8NH3+ SO![]() +4NH
+4NH![]() =2[Co(NH3)6]2++SO
=2[Co(NH3)6]2++SO![]() +5H2O Co(OH)3的Ksp太小,难以浸出,而Co(OH)2的Ksp较大,加入Na2SO3把三价钴还原成二价钴,有利于钴的浸出 50℃以上,钴的浸出率随温度的升高变化不大,且温度升高,促进氨逸出且能耗增大; 将钴渣粉碎,增大接触面积、升高温度、加强搅拌等 与方法2相比,方法1中Fe(OH)3不溶于氨水,减少了后续分离Fe3+的操作
+5H2O Co(OH)3的Ksp太小,难以浸出,而Co(OH)2的Ksp较大,加入Na2SO3把三价钴还原成二价钴,有利于钴的浸出 50℃以上,钴的浸出率随温度的升高变化不大,且温度升高,促进氨逸出且能耗增大; 将钴渣粉碎,增大接触面积、升高温度、加强搅拌等 与方法2相比,方法1中Fe(OH)3不溶于氨水,减少了后续分离Fe3+的操作
【解析】
方法1:根据已知②,将钴渣用氨水和硫酸铵溶液、亚硫酸钠溶液“氨浸”,Fe(OH)3不溶,Co(OH)3浸取后得到含[Co(NH3)6]2+的溶液,过滤将Fe(OH)3分离;
方法2:加入硫酸浸取,得到含Co3+、Fe3+的溶液,再加入适量的Na2SO3将Co3+、Fe3+还原成Co2+、Fe2+,然后经过系列操作除去其中的铁元素,得到含Co2+的滤液。
(1)氨水中的溶质为NH3,已知氨水的质量百分数为a,密度为ρg·cm-3,则其物质的量浓度c=![]() mol/L;“氨浸”过程中的反应物有Co(OH)3、NH3、(NH4)SO4、Na2SO3,反应过程中SO
mol/L;“氨浸”过程中的反应物有Co(OH)3、NH3、(NH4)SO4、Na2SO3,反应过程中SO![]() 将Co(OH)3还原为[Co(NH3)6]2+,则
将Co(OH)3还原为[Co(NH3)6]2+,则![]() 被还原成
被还原成![]() ,根据电子守恒、原子守恒和电荷守恒可得离子方程式为2Co(OH)3+8NH3+ SO
,根据电子守恒、原子守恒和电荷守恒可得离子方程式为2Co(OH)3+8NH3+ SO![]() +4NH
+4NH![]() =2[Co(NH3)6]2++SO
=2[Co(NH3)6]2++SO![]() +5H2O;
+5H2O;
(2)据图可知加入Na2SO3比未加Na2SO3时钴的浸出率要高,这是因为:Na2SO3具有还原性,可以将+3价的Co元素还原为+2价,再结合题目信息可知Co(OH)2的Ksp比Co(OH)3大的多,所以浸出率不同的原因是:Co(OH)3的Ksp太小,难以浸出,而Co(OH)2的Ksp较大,加入Na2SO3把三价钴还原成二价钴,有利于钴的浸出;
(3)据图可知,50℃时,钴的浸出率达到了95%左右,已经很高,温度升高,浸出速率可能会更快,但是钴的浸出率变化不大,反而会使更多的氨气挥发,且能耗增大;
(4)钴渣是固体,所以将其粉碎,增大接触面积,或者升高温度、加强搅拌等都可以增大酸溶速率;
(5)根据分析可知,与方法2相比,方法1中Fe(OH)3不溶于氨水,减少了后续分离Fe3+的操作,缩短流程、减少步骤,降低了生产成本。

【题目】CO在工农业生产及科学研究中有着重要的应用。
(1)CO催化脱硫:科学研究发现CoS对CO还原SO2实现脱硫、并回收S有很好的催化效果,该反应的化学方程式为__________。
(2)CO催化脱氮:在一定温度下,向2 L的恒容密闭容器中充入4.0 mol NO2和4.0 mol CO,在催化制作用下发生反应:2NO2(g)+4CO(g)![]() N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
N2(g)+4CO2(g) ΔH=-1227.8 kJ/mol,测得相关数据如下:
时间 浓度 | 0 min | 5 min | 10 min | 15 min | 20 min |
c(NO2)/mol·L-1 | 2.0 | 1.7 | 1.56 | 1.5 | 1.5 |
c(N2)/mol·L-1 | 0 | 0.15 | 0.22 | 0.25 | 0.25 |
①其他条件不变,若不使用催化剂,则0~5 min内NO2的转化率将_____(填“变大”“变小”或“不变”)。
②下列表述能说明该反应已达到平衡状态的是______(填序号)。
A.CO的化学反应速率为N2的4倍 B.气体的颜色不再变化
C.化学平衡常数K不再变化 D.混合气体的密度不再变化
③有利于提高该反应中NO2平衡转化率的条件是_____(填序号)。
A.高温低压 B.低温高压 C.高温高压 D.低温低压
(3)CO与Ni发生羰化反应形成的络合物可作为催化烯烃反应的催化剂。Ni的羰化反应为Ni(s)+4CO(g)![]() Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的
Ni(CO)4(g) ΔH<0,T0温度下,将足量的Ni粉和3.7 mol CO加入到刚性密闭容器中,10 min时反应达到平衡,测得体系的压强为原来的![]() 。则:
。则:
①0~10 min内平均反应速率v(Ni)=___g·min-1。
②研究表明,正反应速率v正=k正·x4(CO),逆反应速率v逆=k逆·x[Ni(CO)4](k正和k逆分别表示正反应和逆反应的速率常数,x为物质的量分数),计算T0温度下的![]() =__。
=__。
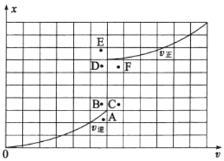
③T1温度下测得一定的实验数据,计算得到v正~x(CO)和v逆~x[Ni(CO)4]的关系如图所示。当降低温度时,反应重新达到平衡,相应的点分别为_______、_______(填字母)。
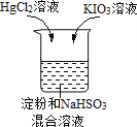
【题目】某同学进行如下趣味化学实验:
将HgCl2溶液和KIO3溶液同时加入 | 反应原理: ①IO ②IO ③Hg2++2I-=HgI2↓(橙红色) |
现象:先产生橙红色沉淀,几秒钟后溶液颜色变为蓝色 |
下列说法不正确的是( )
A.反应①中IO![]() 表现了氧化性
表现了氧化性
B.反应①对反应②的进行有促进作用
C.该实验条件下,反应速率:③>②
D.用Na2SO3溶液代替NaHSO3进行实验,现象相同