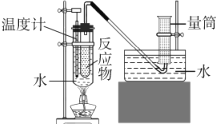
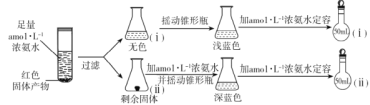
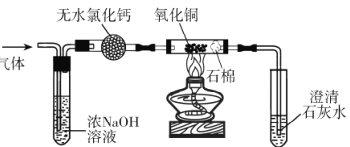
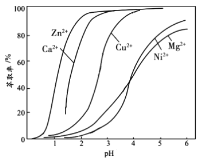
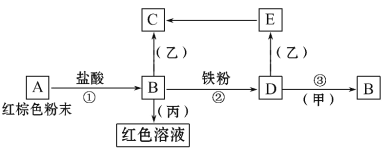
题目内容
【题目】某溶液中含有Ba2+,Cu2+,Ag+,现用NaOH溶液、盐酸和Na2SO4溶液将这三种离子逐一沉淀分离。其流程图如右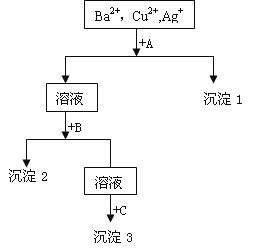
(1)沉淀的化学式:沉淀1___________,沉淀2__________,沉淀3____________;
(2)写出混合液+A的离子方程式________________________________________;
溶液+B的离子方程式_____________________________________。
【答案】AgCl Cu(OH)2(或BaSO4) BaSO4)(或Cu(OH)2) Ag++Cl-== AgCl Cu2++2OH-== Cu(OH)2(或SO42-+Ba2+==BaSO4)
【解析】
要使Ba2+、Cu2+、Ag+逐一沉淀分离,必须考虑除杂试剂的加入顺序。由于OH-、SO42-均能同时与两种阳离子生成沉淀,故应先加入盐酸。除去Ag+,反应的离子方程式:
Ag++Cl-=AgCl↓,然后再加NaOH(或Na2SO4),除去Cu2+(或Ba2+)。
(1)由于OH-、SO42-均能同时与两种阳离子生成沉淀,故应先加入盐酸。第一种沉淀是AgCl,Ba2+、Cu2+分别与SO42-、OH-生成沉淀,不存在顺序关系,故第二种沉淀Cu(OH)2(或BaSO4),第三种沉淀为BaSO4 (或Cu(OH)2);
(2)溶液+A生成氯化银沉淀的离子方程式为:Ag++Cl-=AgCl;溶液+B的离子方程式则两个均可以,答案为:Cu2++2OH-== Cu(OH)2(或SO42-+Ba2+==BaSO4)。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】中国研究人员研制出一种新型复合光催化剂,利用太阳光在催化剂表面实现高效分解水,其主要过程如下图所示。

已知:几种物质中化学键的键能如下表所示。
化学键 | H2O中H—O键 | O2中O=O 键 | H2中H—H键 | H2O2中O—O键 | H2O2中O—H键 |
键能kJ/mol | 463 | 496 | 436 | 138 | 463 |
若反应过程中分解了2 mol水,则下列说法不正确的是
A. 总反应为2H2O![]() 2H2↑+O2↑
2H2↑+O2↑
B. 过程I吸收了926 kJ能量
C. 过程II放出了574 kJ能量
D. 过程Ⅲ属于放热反应