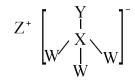【题目】某小组研究了铜片与![]() 反应的速率,实现现象记录如下表。
反应的速率,实现现象记录如下表。
实验 | 时间段 | 现象 |
|
| 铜片表面出现极少气泡 |
| 铜片表面产生较多气泡,溶液呈很浅的蓝色 | |
| 铜片表面均匀冒出大量气泡 | |
| 铜片表面产生较少气泡,溶液蓝色明显变深,液面上方呈浅棕色 |
为探究影响该反应速率的主要因素,小组进行如下实验。
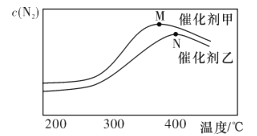
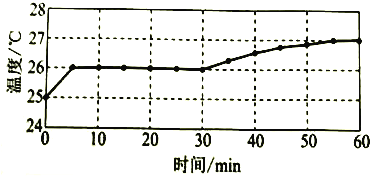
实验I:监测上述反应过程中溶液温度的变化,所得曲线如下图。
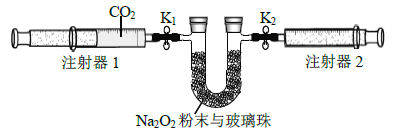
实验II:②-④试管中加入大小、形状相同的铜片和相同体积、 ![]() 。结果显示:
。结果显示:![]() 对
对![]() 和
和![]() 反应速率的影响均不明显,
反应速率的影响均不明显,![]() 能明显加快该反应的速率。
能明显加快该反应的速率。
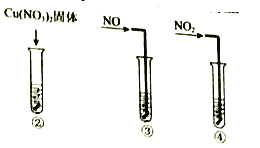
实验III:在试管中加入铜片和![]() ,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有
,当产生气泡较快时,取少量反应液于试管中,检验后发现其中含有![]() 。
。
(1)根据表格中的现象,描述该反应的速率随时间的变化情况:____________。
(2)实验![]() 的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
的结论:温度升高___________(填“是”或“不是”)反应速率加快的主要原因。
(3)实验II的目的是:__________
(4)小组同学查阅资料后推测:该反应由于生成某中间产物而加快了反应速率。请结合实验II、III,在下图方框内填入相应的微粒符号①____②_____,以补全催化机理。
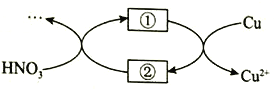
(5)为验证(4)中猜想,还需补充一个实验:__________(请写出操作和现象)。
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D