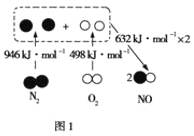
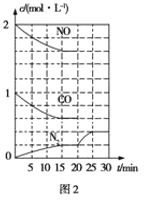
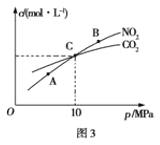
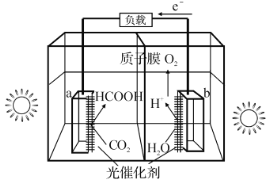
题目内容
【题目】设NA为阿伏加德罗常数的值,下列叙述中正确的是( )
A.常温常压下,32 g氧气的体积约为22.4L
B.1.8 g NH4+中含有的质子数为NA
C.常温常压下,48g O3含有的氧原子数为3NA
D.2.4 g金属镁变为镁离子时失去的电子数为0.1NA
【答案】C
【解析】
A.32g氧气的物质的量为1mol,常温常压下,气体摩尔体积不是22.4mol/L,则其体积不为22.4L,故A错误;
B.1.8g NH4+的物质的量为n=![]() =0.1mol,而NH4+中含11个质子,故0.1mol NH4+中含有的质子个数为1.1NA个,故B错误;
=0.1mol,而NH4+中含11个质子,故0.1mol NH4+中含有的质子个数为1.1NA个,故B错误;
C.臭氧由氧原子构成,故48g臭氧中含有的氧原子的物质的量为3mol,故个数为3NA个,故C正确;
D.2.4g镁的物质的量为0.1mol,而镁反应后变为+2价,故0.1mol镁失去0.2NA电子,故D错误;
故答案选C。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】下列实验“操作和现象”与“结论”对应且正确的是( )
操作和现象 | 结论 | |
A | 向盛有浓硫酸的试管中加入铜片,铜片很快开始溶解,并放出刺激性气味的气体 | 浓硫酸具有强氧化性 |
B | 向两支盛有KI3的溶液的试管中,分别滴加淀粉溶液和硝酸银溶液,前者溶液变蓝,后者有黄色沉淀 | KI3溶液中存在平衡:I |
C | 向一定量的硝酸银溶液中先滴加KCl溶液,再滴加KI溶液,先出现白色沉淀,后出现黄色沉淀 | Ksp(AgCl)>Ksp(AgI) |
D | 室温下,用pH试纸分别测定浓度为0.1mol/LNaClO溶液和0.1mol/LCH3COONa溶液的pH | 比较HClO和CH3COOH的酸性强弱 |
A.AB.BC.CD.D